Гідрування і деструктивне гідрування - реакції другого порядку під високими тисками водню рівноважні виходи зсуваються в бік освіти насичених з'єднань, і гідрування йде практично до кінця. [C.141]
Швидкість реакції в присутності каталізатора становить k [СО2] [at], причому - константа, характерна для даного каталізатора і залежить від температури, а [at] - концентрація каталітичної добавки. Реакція має, таким чином. перший порядок. У присутності іона або молекули, яка буде реагувати з іоном водню. утворюється по реакції (Х, 2), каталізувати гідратація триватиме аж до досягнення рівноваги. Так, в присутності іонів карбонату (і за умови незначного рівноважного тиску СОа над розчином) слідом за реакцією [c.243]

Фтористоводнева КИСЛОТА (фтороводородной к-та), р-р фтористого водню у воді. Устар. назв.- плавикова к-та. В системі НР - Н Про можуть існувати 3 соед. НР НР (НЗО Р "), HiO-2HF (НЗО + HF) і HjO-4HF, т.пл. яких брало соотв. -36, -78 (з разл.) І -100 ° С т.-пл. евтектіч. суміші HjO - H2O HF -72 С для азеотропной суміші (38,2% по масі HF) т. кип. 114,5 ° С. При всіх складах, відмінних від азеотропного, Ф.к. випаровується інконгруентно. Рівноважний тиск парів НР і Н Про над Ф.к. описується рівнянням Igp (Ha) = А - BIT, значення коеф. см. в табл. [c.202]
Кінетика процесу гідрокрекінгу. Реакції розщеплення і ізомеризації, що протікають в процесах гідрокрекінгу. є типовими реакціями першого порядку. Розпад вуглеводнів гальмується освітою продуктів розщеплення і зміною умов адсорбції [271,272, 273]. Г ідрірованіе і деструктивне гідрування - реакції другого порядку під високим тиском водню рівноважні виходи зсуваються в бік освіти насичених з'єднань і гідрування може протікати практично до кінця. Для підтримки необхідного парціального тиску водню потрібно його значний надлишок в зв'язку з цим бімолекулярні стадії гідрогенізації будуть описуватися рівняннями для псевдомономолекулярну реакцій. Таким чином. больщінства реакцій, що протікають при гідрокрекінгу, повинно мати перший порядок. є для розщеплення і ізомеризації істинним, а для гідрування - удаваним [274]. [C.245]
Аналогічно цьому робота з перекладу трьох молей водню від тиску р2 до рівноважного тиску виразиться рівнянням [c.196]
Для більш наочної оцінки, наскільки мало це значення Кр, покладемо умовно, що рівноважні тиску метану і водню рівні [c.146]
Отже, між кількістю адсорбованого водню (або ступенем заповнення поверхні) і логарифмом рівноважного тиску водню існує лінійна залежність [c.43]
Розрахувати рівноважний тиск водню без урахування його розчинності в титані. [C.229]
Для вимірювання ізотерм адсорбції чистих газів в адсорбер з балона через буферну ємність накачують газ до тиску - (1-2) -10 Па (100-200 кгс / см). Після того як тиск в адсорбере, реєстроване зразковим манометром. встановилося, газ з адсорбера повільно випускається швидкість газу, що виходить за Реометр підтримується постійної - 300 см / хв. Точний обсяг вийшов газу визначають в газометр. Через певні проміжки часу одночасно заміряють кількість виділеного газу і рівноважний тиск в системі. Залишок газу віддувається пз адсорбера воднем при атмосферному тиску. причому склад виходить суміші визначають газоаналізатором по теплопровідності, а кількість адсорбата. виділився ири отдувкой, розраховують інтегруванням вихідний щепу. [C.167]
Якщо у вихідному інертному газі міститься 1% кисню і 2,1% водню, то рівноважний тиск кисню при 500 ° С дорівнює 7-10 "2б ат. У водні (без інертних домішок) рівноважний парціальний тиск кисню ще менше. При 500 ° С і початковому вмісті кисню 1% воно становить 7-10 "32 ат. Результати розрахунку показують, що до 500 ° С для суміші стехіометричного складу (N3 + ЗНЗ) і до 1000 ° С при невеликому надлишку водню реакція взаємодії водню з киснем може розглядатися теж як необоротна. [C.330]
Приклад 13. При Г = 693К водень і йод поміщені в посудину. Посудина закритий реакція між воднем і йодом йде при У = onst. Після того як встановилася рівновага. визначені рівноважні тиску реагентів і отримано /. = 0,007-10 н м. = 0,300-105 н1м. Pf. = 0,32 -10 hJm. Обчислити вихідний тиск Нз і h (н / м). [C.238]
Кожному потенціалу можна співвіднести фіктивне рівноважний тиск водню в сполученої системі 2НзО / Н2 [c.50]
Тому рівноважний тиск газу А над розчином при тому ж ДПРБ нижче, ніж за відсутності в розчині перетворення. Розчинність ж відповідно підвищується. Цим пояснюється виключно висока розчинність в воді таких газів, як хлористий водень і аміак. [C.38]

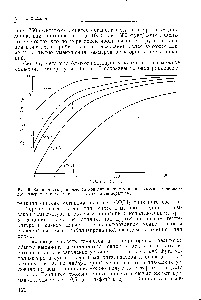
Процес утворення окремих екзотермічних гідридів в залежності від тиску і температури можна уявити за допомогою ізотерм рівноважних тисків. На рис. 47 предст. влені ізотерми рівноважних тисків для ряду гідридів [71, ьі, 81], з яких випливає. що якщо рівноважний та ня водню підвищується, то концентрація його в сплаві зростає. При досягненні межі розчинності може виникнути нова фаза. для існування якої за законом фаз Гіббса характерне утворення плато тиску. Перетворення всього сплаву в первинний гідрид (/ фаза) відповідає стехіометрії фази і інтенсивному росту тиску. Якщо сплав може утворювати другу фазу (-фазу), як, наприклад, РеТ1 (рис. 47, б), то з'являється ще одне плато тиску. Після якого тиск знову круто зростає. [C.81]