Одні електроліти в розчинах повністю розпадаються на іони. Вони називаються сильними.
Інші електроліти тільки частково розпадаються на іони, тобто велика частина їх молекул залишається в розчині в недиссоциированном вигляді. Такі електроліти називаються слабкими.
Дана властивість речовини не абсолютно, і залежить не тільки від його природи, а й від природи розчинника. Чим більше діелектрична постійна розчинника, тим сильніше його іонізуюча слабкість. Так, у водних розчинах (# 949; (Н2 О) = 80). LiCl і NaCl поводяться як сильні електроліти. Але якщо їх розчинити в оцтової кислоти (# 949; = 6) або ацетоні (# 949; = 21), то вони починають проявляти властивості слабких електролітів.
У водних розчинах сильними електролітами є солі, розчинні підстави (утворені, як правило, лужними і лужноземельними металами), деякі неорганічні або мінеральні кислоти (HCl, HBr, HI, H2 SO4. HNO3 і ін.).
У той же час багато органічні кислоти, деякі неорганічні кислоти (HNO2. HF, H2 S, H2 SiO3. H3 PO4 і т.д.), нерозчинні в Н2 Про заснування поводяться як слабкі електроліти.
Речовини, в яких частинки пов'язані різними видами хімічного зв'язку, розпадаються на іони спершу по іонним зв'язкам
а потім - по найбільш полярним ковалентним зв'язкам
Гетеролітичною розрив малополярних або неполярних ковалентних зв'язків в процесах дисоціації таких речовин, як правило, не відбувається.
Кількісно процес розпаду молекул електроліту на іони оцінюється за допомогою ступеня електролітичноїдисоціації # 945; .
Ступінь дисоціації - це відношення числа розпалися на іони молекул речовини до загальної кількості його молекул в розчині (розпалися і нераспавшіхся):
NО = NД + NH (число непродіссоціірованних молекул електроліту в розчині)
Так як число часток речовини (N) і їх хімічне кількість (n) пов'язані між собою співвідношенням N = n # 8729; NA. то ступінь дисоціації можна ще розрахувати і іншим способом:
Для сильних електролітів # 945; близька до одиниці. Практично всі їх молекули в розчині знаходяться в дисоційованому вигляді, процес асоціації протікає вкрай незначно.
У зв'язку з цим в рівняннях дисоціації даних речовин замість знака оборотності «» ставлять знак «®» (тобто використовують стрілку тільки в напрямку розпаду), наприклад:
Для слабких електролітів ступінь дисоціації дуже мала (# 945;<<1). Так, для воды при 20 о С α ≈ 1 ∙ 10 –9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результаті дисоціації електроліту відбувається збільшення числа його частинок в розчині. Це дозволяє експериментально визначити ступінь дисоціації по вимірюванню тих властивостей розчину, які залежать тільки від кількості містяться в ньому частинок розчиненої речовини, але не від їх природи, розмірів, маси. До таких властивостей відносяться температура кипіння і замерзання розчину, осмотичний тиск і деякі інші.
Для розчинів слабких електролітів значення # 945 ;, певні різними способами, як правило, збігаються і завжди значно менше одиниці, що добре узгоджується з теорією Арреніуса.
Як показали експериментальні дослідження, ступінь дисоціації слабких електролітів залежить від температури розчину і його концентрації.
Таблиця 8. Зміна ступеня дисоціації оцтової кислоти в залежності від її молярної концентрації в розчині
Ссн3 СООН, моль / дм 3
При підвищенні температури розчину ступінь дисоціації збільшується, тому що при цьому краще забезпечується поляризація і полегшується подальший розрив ковалентного полярного зв'язку в молекулах електроліту. При зниженні температури # 945; зменшується.
зростає # 945; і при зменшенні концентрації розчинів, тобто при їх розведенні (табл. 8), тому що при цьому товщина розділяє іони водної прошарку стає більше, тому електростатичне взаємодія між ними, що приводить до асоціації іонів в молекули, спостерігається рідше.
При нескінченно великому розведенні ступінь дисоціації електроліту прагне до свого максимального значення, тобто до одиниці (рис. 30).
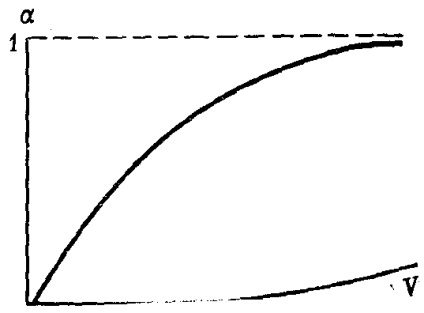
Мал. 30. Зміна ступеня електролітичноїдисоціації # 945; з розведенням V (схема)
Таким чином, для слабких електролітів # 945; не є постійною величиною. Тому їх здатність до розпаду на іони зручніше порівнювати по константі дисоціації, яка представляє собою константу рівноваги оборотної реакції електролітичного розкладання молекул електроліту.
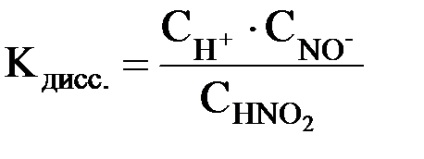
де СН +. СNO2 -. CHNO2 - рівноважні молярні концентрації іонів H +. NO2 - і непродіссоціірованних молекул HNO2.
Константа дисоціації слабких електролітів не залежить від їх концентрації в розчині навіть при значному розбавлені і при даній температурі залишається постійною величиною (табл. 9). Зі збільшенням температури розчину константа дисоціації слабких електролітів у багатьох випадках змінюється складним чином (рис. 31).
Таблиця 9. Залежність величини Kдісс. оцтової кислоти в розчині від її молярної концентрації при Т = 298 K
Ссн3 СООН, моль / дм 3
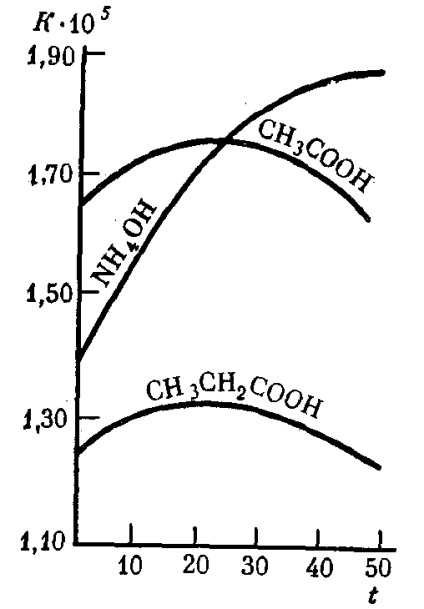
Мал. 31. Залежність константи дисоціації Kнекоторих слабких електролітів у водних розчинах від температури t (° С)
Чим менше Kдісс .. тим слабшим є даний електроліт. Наприклад, оцтова кислота (Kдісс. = 1,85 · 10 -5) майже в 220 000 разів сильніше синильної HCN (Kдісс. = 4,8 · 10 -10) і приблизно в 10 разів слабкіше мурашиної кислоти (Kдісс. = 1, 8 · 10 -4).
Існують слабкі електроліти (багатоосновні кислоти, многокіслотние підстави) процес розпаду яких на іони протікає східчасто, тобто в кілька стадій. При цьому кожна стадія характеризується своєю величиною константи дисоціації.
Наприклад, в 2 стадії здійснюється дисоціація сірководневої кислоти:
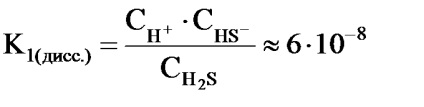
2) HS - H + + S 2 -
Сумарне рівняння реакції дисоціації H2 S виглядає наступним чином:
H2 S 2H + + S 2
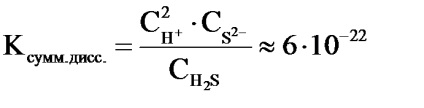
Величина константи дисоціації для сумарного рівняння і значення констант дисоціації окремих стадій пов'язані між собою співвідношенням:
При ступінчастою дисоціації розпад слабкого електроліту на кожній наступній стадії відбувається в меншій мірі, ніж на попередній, тобто K1> K2> K3 і т.д. Це пояснюється тим, що відрив іона відбувається вже не від нейтральної молекули (як на першій стадії), а від частки з усе більш зростаючим зарядом і вимагає тому великих витрат енергії.
Часто для оцінки сили слабкого електроліту замість величини константи дисоціації використовують її десятковий логарифм, узятий з оберненим знаком (pK)
У цьому випадку чим більше величина pK, тим слабшим є електроліт.