Одним з основних факторів, що впливають на швидке зростання мікроорганізмів і максимальний синтез ними різних біологічно активних речовин, є поживні середовища. При підборі живильного середовища слід враховувати її повноцінність, т. Е. Обгрунтований і збалансований набір різних поживних сполук, необхідних мікроорганізму для побудови зростаючої клітини і синтезу кінцевого цільового продукту.
Для нормального росту і розвитку мікроорганізмів в живильному середовищі повинні бути присутніми всі елементи, з яких формується клітина. Багатьом мікроорганізмам для зростання в тій чи іншій живильному середовищі необхідний цілий ряд додаткових умов: певні концентрації водневих іонів, окислювально-відновний потенціал середовища, необхідні співвідношення різних іонів. Деякі мікроорганізми з порушеними спадковими ознаками (ауксотрофності мутанти) потребують окремих факторах росту, які вони самі синтезувати не можуть: амінокислотах, пуринів, вітамінах та ін.
Для отримання продуктів мікробіологічного синтезу в залежності від мікроорганізму-продуцента і технології виробництва використовуються відмінні за складом живильні середовища. В одному технологічному процесі для отримання і розмноження посівного матеріалу і для стадії виробничого культивування можуть застосовуватися поживні середовища різного складу.
Основними компонентами живильного середовища є джерела вуглецю і азоту.
углеродсодержащими сировину
Найбільш характерним вуглець-містять сировиною є вуглеводи. Вуглеводи - одна з найважливіших складових частин живильного середовища для вирощування мікроорганізмів. Вони використовуються для синтезу клітинних структур і одночасно служать джерелом енергії. Для промислового біосинтезу найбільш часто застосовують глюкозу або крохмаль. В середовища для культивування вводять технічну глюкозу або маточник (гидрол), що залишається після виділення кристалічної глюкози. Гідрол містить да 50% редукуючих цукрів (в перерахунку на глюкозу).
При введенні в середу технічних продуктів їх кількість розраховують за вмістом редукуючих речовин в перерахунку на чисті вуглеводи. Так, зокрема, надходять при використанні в складі середовищ гідролізатів різних відходів переробки сільськогосподарської сировини (соняшникове лушпиння, кукурудзяні качани, деревна тріска і ін.).
Крохмаль, на 96-97,5% складається з полісахаридів, які утворюють при кислотному гідролізі глюкозу, може бути використаний тими мікроорганізмами, які здатні до біосинтезу амилолитических ферментів.
азотовмісна сировину
Біосинтез багатьох біологічно активних речовин здійснюють на поживних середовищах складного, а часто непостійного хімічного складу. У них різні джерела азоту можуть бути представлені білками, пептидами або вільними амінокислотами. При промислової ферментації використовують кукурудзяний екстракт, соєве борошно або гідролізат дріжджів. Кукурудзяний екстракт містить весь комплекс амінокислот, але їх кількісний склад може значно змінюватися від партії до партії. Приблизний хімічний і амінокислотний склад кукурудзяного екстракту представлений нижче.

Білковими речовинами багата соєве борошно. Вона так само, як і кукурудзяний екстракт, містить всі поширені амінокислоти, проте в основному вони пов'язані у вигляді білків. При оцінці природних речовин (соєве борошно, кукурудзяний екстракт і т. П.) Слід брати до уваги, що їх вплив на спрямований процес обміну речовин мікроорганізмів обумовлюється не тільки наявністю білків і амінокислот, а й присутністю поряд з ними вуглеводів, нуклеїнових кислот, жирів , мікроелементів, органічних кислот та інших сполук.
З мінеральних азотовмісних речовин найбільш часто застосовують амонійні солі сірчаної, соляної або азотної кислот. Як показала практика, сульфат амонію виявився придатним для біосинтезу багатьох сполук.
У речовинах, що містять амонійний азот, іон амонію знаходиться в поєднанні з аніоном будь-якої кислоти, наприклад сірчаної або фосфорної. Потреба мікроорганізмів в сере і фосфорі менше, ніж в азоті, тому при використанні азоту в середовищі будуть накопичуватися аніони і буде підвищуватися кислотність середовища. Щоб уникнути цього в процесі культивування мікроорганізмів в середу додають крейду або ведуть подтітровку лугом.
Вплив джерел азоту на біосинтез залежить безпосередньо не тільки від самого джерела азоту, але і від загального складу середовища. Суттєве значення має співвідношення кількостей присутніх в середовищі азоту і вуглецю. Їх дозування необхідно регулювати відповідно до оптимальними межами концентрації найбільш важливих речовин для даної культури. Для кожного штаму-продуцента ця величина буде різною.
Приготування і стерилізація поживних середовищ
Для приготування виробничої живильне середовище попередньо розчиняють цукру і солі, ретельно суспендують такі нерозчинні компоненти, як соєве борошно або крейда. Крахмалсодержащего сировину попередньо клейстерізующімся. Для прискорення ці процеси проводять в невеликих апаратах з мішалками (реактори), а потім розчини змішують в закритому змішувачі-реакторі з плоским дном, забезпеченим барботажний пристроєм для введення пара. Концентрат середовища, що становить близько однієї третини необхідного обсягу, для остаточного розчинення і суспендування нагрівають гострим паром до 70-80 ° С. При цій температурі не відбувається розкладання термолабільних компонентів середовища. Приготування більш концентрованих середовищ дає можливість використовувати змішувачі меншої місткості.
Необхідна умова успішної стерилізації живильного середовища - ретельна гомогенізація її твердих компонентів. Тривалість витримки (при температурі стерилізації) великих частинок, повільно прогріваються при стерилізації, буває менше розрахункової, і в них зберігається стороння мікрофлора, здатна інфікувати культуральну рідину.
Результати досліджень процесу перемішування свідчать про те, що швидкість розчинення речовини в рідині пропорційна потужності мішалки, що припадає на одиницю об'єму рідини. У зв'язку з цим реактори для приготування живильного середовища повинні бути забезпечені досить потужними мішалками, а також перегородками-відбивачами, що не допускають завихрення і обертання рідини в апаратах (табл. 2.1).
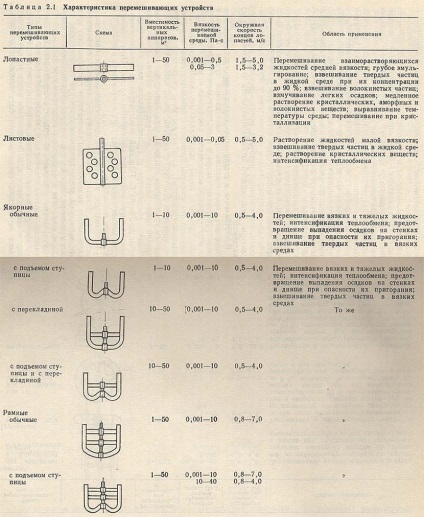
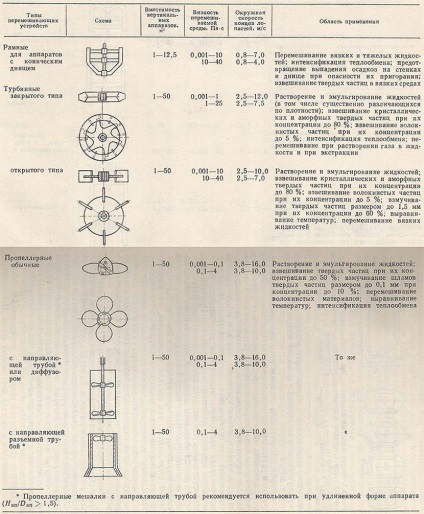
У табл. 2.1 наведені основні типи перемішують і вказані області їх застосування. Склад використовуваних у виробництві поживних середовищ обумовлює застосування певних типів пристроями, як в апаратах для підготовки окремих видів сировини (розведення меляси і клейстеризація крохмалю), так і в самому реакторі (змішувачі) для приготування живильного середовища. Якщо необхідно середу піддати циклічної стерилізації, то цю операцію можна здійснити в ферментаторі. При цьому середовище і обладнання стерилізуються одночасно (рис. 2.1).
На рис. 2.1 наведені можливі схеми нагрівання та охолодження ферментатора. Найчастіше використовують комбінований нагрівання гострою парою і через сорочку або змійовик. Для циклічної стерилізації, як правило, встановлено, що найбільш зручно і економічно вигідно підтримувати температуру 121 ° С, що відповідає тиску насиченої пари 100 кПа. У звичайних умовах поживні середовища витримують при температурі стерилізації від 30 до 40 хв. Повний цикл нагрівання, витримки та охолодження для великих ферментаторів (63 м3) обчислюється кількома годинами (рис. 2.2).
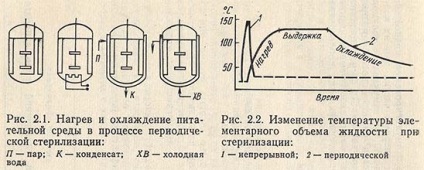
Метод циклічною стерилізації середовища в апараті дуже простий. Однак він має суттєві недоліки в порівнянні з безперервним методом. По-перше, погіршується якість живильного середовища через більш тривалого впливу високої температури, ніж при безперервній стерилізації, що наочно видно з рис. 2.2. По-друге, потрібно підвищена витрата пара в період нагріву середовища, і, по-третє, циклічний процес важче піддається автоматизації. Тому в даний час його застосовують для стерилізації середовища тільки в апаратах малого обсягу.
Теплова стерилізація призводить до певних хімічних змін в складі живильного середовища. Деякі з них зводяться до розкладання нестійких до нагрівання сполук, що призводить до втрати необхідних для харчування мікроорганізму речовин. При інших змінах відбувається взаємодія різних компонентів середовища, зокрема між амонійними або аминосоединений і вуглеводами, що призводить до утворення продуктів, що пригнічують ріст мікроорганізмів. Більшість змін хімічних інгредієнтів середовища виникає при температурах вище, ніж температура стерилізації.
Отже, ефективна стерилізація в поєднанні з мінімальними змінами середовища може бути досягнута шляхом застосування більш високої температури, а також швидкого нагрівання та охолодження. У циклічних системах це забезпечується за допомогою глухого пара, що проходить через змійовики або нагрівають сорочки, і за допомогою гострої пари, інжектіруемого через штуцери для засіву, подачі повітря і взяття проб. В результаті такого прийому вся арматура, поєднана з ферментатором, стерилізується проходять гострою парою. Обробка гострою парою призводить до утворення конденсату. У зв'язку з цим необхідно заздалегідь враховувати розведення середовища конденсатом і вносити відповідну поправку в пропис спочатку приготавливаемого складу середовища. Тоді до кінця стерилізації середовище буде мати необхідну концентрацію всіх поживних компонентів. Якщо стерилізацію вуглеводів проводити окремо, а потім додавати їх асептически до іншої заздалегідь простерилизованной середовищі, то можна запобігти реакцію між вуглеводами та іншими складовими компонентами середовища. Ті компоненти, які надзвичайно чутливі до дії тепла, також можуть бути простерилізовані окремо. При цьому для стерилізації може застосовуватися опромінення або фільтрація через знепліднювати фільтри.
Раніше нами були відзначені переваги високотемпературної короткочасної стерилізації як прийому, що дозволяє звести до мінімуму погіршення поживних якостей середовища без зниження ефективності самої стерилізації. Такий прийом найбільш результативно може бути реалізований при використанні системи безперервної стерилізації в потоці (рис. 2.3). Середовище готується в окремій ємності 1, а потім насосом 2 прокачується через установку для стерилізації в заздалегідь простерилізовані ферментатор. Установка безперервної стерилізації складається з послідовно з'єднаних секцій (апаратів): нагрівача 3, видержіватель 4 і холодильника 5. У такій системі можна застосовувати більш високі температури, ніж ті, які можуть вважатися економічними при циклічної стерилізації. В результаті тривалість витримування середовища при максимальній температурі різко скорочується, а періоди нагрівання і охолоджування не перевищують декількох секунд (див. Рис. 2.2).
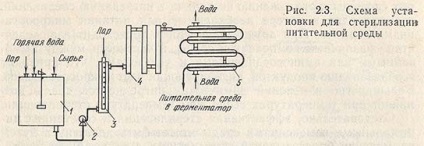
Для середовища, вільної від суспендованих твердих частинок, підтримання температури на рівні 150-160 ° С забезпечує миттєву стерилізацію. При цьому хімічні зміни, які відбуваються в середовищі, настільки несуттєві, що ними можна знехтувати. Якщо в середовищі присутні тверді суспендовані частинки, то оптимальна для стерилізації температура повинна мати більш низьке значення, оскільки потрібен додатковий час для проникнення тепла всередину таких частинок. Це значення буде визначатися природою суспендованих частинок, а також допустимої в кожному окремому випадку ступенем початкового зміни складу середовища. Найбільш поширеною в таких випадках вважається температура стерилізації, рівна 135 ° С, а тривалість витримування від 5 до 15 хв. У всіх випадках безперервної стерилізації охолодження середовища практично здійснюється в теплообмінниках типу труба в трубі або в протиточних пластинчастого типу, а нагрівання - шляхом інжектування гострого пара.
Різні типи секцій, які використовуються в системі безперервної стерилізації, представлені на рис. 2.4. Енергозберігаюча пара може бути досягнуто включенням в систему спеціальної регенеративної ступені для попереднього підігріву холодної нестерильного середовища. Безперервна стерилізація дає можливість відтворити однаковий ступінь хімічних змін середовища при різних масштабах виробництва. Крім того, на підприємстві різко знижуються коливання в споживанні пари і води.
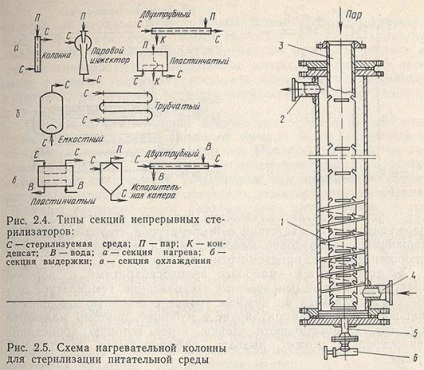
До кожного з апаратів системи стерилізації пред'являються різні технологічні вимоги, і в залежності від режиму і масштабів виробництва конструкція кожного з цих апаратів може бути неоднаковою.
Основна вимога до нагрівача, - швидке нагрівання до температури стерилізації при найменшій витраті пара.
Нагрівач (рис. 2.5) зазвичай є колонку, виготовлену з двох труб. Зовнішня труба є корпусом. Пара подається зверху по внутрішній трубі 3 з щілиновидними прорізами, через які він надходить в середу, і за 10-15 с нагріває кожен обсяг її. Живильне середовище подається знизу через штуцер 4, нагріта середу до температури стерилізації виходить через штуцер 2. Рух середовища відбувається по спіралі завдяки наявності гвинтових напрямних 1. При зупинці колонки скидання конденсату проводять через патрубок5 при відкриванні крана 6. Апарат відрізняється простотою і малими розмірами, але робота його супроводжується гідравлічними ударами при конденсації пари і втратою конденсату.
У струменевому нагрівачі інтенсивна турбулентність потоку середовища і пара запобігає гідравлічні удари і відкладення опадів.
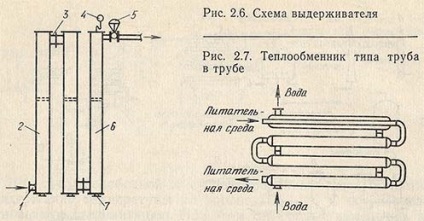
Основна вимога до видержіватель, - сталість тривалості перебування в ньому кожного обсягу середовища при певній температурі стерилізації. Щоб тривалість витримки була постійною, нестерильна среда, що надходить в апарат, не повинна змішуватися зі стерильною середовищем, що виходить з нього. Іншими словами, видержіватель повинен працювати за принципом повного витіснення. На рис. 2.6 показаний трубчастий видержіватель (стерилізатор). Він має вхідний штуцер 1 і складається з трьох труб 2, з'єднаних послідовно перехідними штуцерами 3. На вихідній трубі встановлено автоматичний регулятор тиску 5 в видержіватель відповідно до температури стерилізації. Видержіватель обладнаний манометром 4 і термометрами 6. Для спорожнення труб передбачені пробки 7.
Холодильник - найбільш великогабаритний і дорогий апарат в системі безперервної стерилізації. Температура середовища підтримується на потрібному рівні за допомогою водопровідної води, яка циркулює в сорочці, тому найменше порушення герметичності стінки, через яку відбувається теплопередача, може викликати інфікування живильного середовища.
Герметичній, добре зберігає стерильність конструкцією є двотрубний теплообмінник (типу труба в трубі) звареної конструкції (рис. 2.7). Для більшої гарантії герметичному середовищі подається по внутрішній трубі теплообмінника. Теплообмінник пластинчастого типу на відміну від двотрубного більш компактний. Він також відрізняється хорошою герметичністю, високим коефіцієнтом теплопередачі, поряд з цим має велику поверхню теплообміну на одиницю об'єму апарату.