Аміак, NH3. найпростіше хімічна сполука азоту з воднем. Один з найважливіших продуктів хімічної промисловості; синтез аміаку з азоту повітря і водню - основний метод отримання т. н. пов'язаного азоту. У природі аміак утворюється при розкладанні азотовмісних органічних речовин. Назва «аміак» - скорочене від грец. hals ammoniakos або лат. sal ammoniacus; так називався нашатир (амонія хлорид), який отримували в оазисі Аммоніум (нині Сива) в Лівійській пустелі.
Фізичні та хімічні властивості. Аміак - безбарвний газ з різким задушливим запахом і їдким смаком. Щільність газоподібного аміаку при 0 ° С і 101,3 кн / м 2 (760 мм рт. Ст.) 0,7714 кг / м 3. температуру кипіння -33,35 ° С, tпл -77,70 ° С, tкpіт 132, 4 ° С, тиск критичне 11,28 Мн / м 2 (115,0 кгс / см 2), щільність критична 235 кг / м 3. теплота випаровування 23,37 кДж / моль (5,581 ккал / моль). Суха суміш аміаку з повітрям здатна вибухати; кордони вибуховості при кімнатній температурі лежать в межах 15,5-28% аміаку. з підвищенням температури межі розширюються. Аміак добре розчинний у воді (при 0 ° С об'єм води поглинає близько 1200 об'ємів аміаку. При 20 ° С - близько 700 об'ємів аміаку). При 20 ° С і 0,87 Мн / м 2 (8,9 кгс / см 2) аміак легко переходить в безбарвну рідину з щільністю 681,4 кг / м 3. сильно заломлюючу світло. Подібно воді. рідкий аміак сильно асоційований, головним чином за рахунок утворення водневих зв'язків. Рідкий аміак практично не проводить електричний струм. Рідкий аміак - хороший розчинник для дуже великого числа органічних, а також для багатьох неорганічних сполук. Твердий аміак - безбарвні кубічні кристали.
Молекула аміаку має форму правильної тригонометричної піраміди з атомом N в вершині; кути між зв'язками H-N-H 108 °, міжатомні відстані H-N-H 1,015, H-H 1,64.
Цікавою властивістю молекул аміаку є їх здатність до структурної інверсії. т. е. до «вивертання навиворіт» шляхом проходження атома азоту крізь утворену атомами водню площину підстави піраміди. Інверсія пов'язана з випромінюванням строго певної частоти, на основі чого була створена апаратура для дуже точного визначення часу (молекулярні генератори). Такі «молекулярні годинник» дозволили, зокрема, встановити, що тривалість земної доби щорічно зростає на 0,43 мсек. Дипольний момент молекули аміаку дорівнює 1,43D. Завдяки відсутності неспарених електронів аміак диамагнитен.
Отримання і застосування. У лабораторних умовах аміак може бути отриманий витісненням його сильними лугами з амонієвих солей за схемою: 2NH4 CI + Ca (OH) 2 = 2NH3 + CaCl2 + 2H2 O. Найстаріший промисловий спосіб отримання аміаку - виділення його з газів, що відходять при коксуванні вугілля. Основний сучасний спосіб промислового отримання аміаку - синтез з елементів - азоту і водню. запропонований в 1908 німецьким хіміком Ф. Габер.
Найбільш поширеним і економічним методом отримання технологічного газу для синтезу аміаку є конверсія вуглеводневих газів. Початковою сировиною в цьому процесі є природний газ. а також попутні нафтові гази. гази нафтопереробки. залишкові гази виробництва ацетилену. Сутність конверсійного методу отримання азото-водневої суміші полягає в розкладанні при високій температурі метану і його гомологів на водень і окис вуглецю за допомогою окислювачів - водяної пари і кисню. До конвертованому газу при цьому додають атмосферне повітря або повітря. збагачене киснем. Синтез аміаку з простих речовин
протікає з виділенням тепла і зменшенням обсягу. Найбільш сприятливими, з точки зору рівноваги. умовами освіти аміаку є можливо більш низька температура і можливо більш високий тиск. Без каталізаторів реакція синтезу аміаку взагалі не відбувається. У промисловості для синтезу аміаку використовують виключно залізні каталізатори. одержувані відновленням сплавлених оксидів заліза Fe3 O4 з активаторами (Al2 O3. K2 O, CaO, SiO2. а іноді і MgO). Важливий етап процесу синтезу - очищення газової суміші від каталітичних отрут (до них відносяться речовини. Містять S, O2. Se, P, As, пари води. CO та ін.).
Способи виробництва синтетичного аміаку розрізняються по вживаному тиску. системи низького (10-15 Мн / м 2), середнього (25-30 Мн / м 2) і високого (50-100 Мк / л 2) тиску. Найбільш поширені системи середнього тиску (30 Мн / м 2 і 500 ° С) (1 Мн / м 2 (10 кгс / см 2). Для збільшення ступеня використання газу в сучасних системах синтезу аміаку застосовують багаторазову циркуляцію азото-водневої суміші - кругової аміачний цикл (див. рис.).
Свіжий газ (азот-воднева суміш) і не прореагували, т. Н. циркуляційні гази надходять спочатку в фільтр 1, де вони очищаються від сторонніх домішок, потім в міжтрубний простір конденсаційної колони 2, віддаючи своє тепло газу. рухається по трубках колони. Далі гази проходять через випарник 3, в якому відбуваються їх подальше охолодження і конденсація аміаку. захопленого циркуляційними газами. Охолоджена суміш газів і сконденсувалася аміак з випарника направляються в розділову частину (сепаратор) конденсаційної колони, де рідкий аміак відділяється і як готовий продукт виводиться по трубі в резервуар 9. Газоподібний аміак. виходить з випарника. проходячи бризгоуловітель 4, звільняється від крапель рідкого аміаку і направляється в цех переробки або в холодильну установку на зріджування. Гази. звільнені від аміаку. з сепаратора поступають в колону синтезу 5. Колона синтезу усередині має катализаторную коробку з трубчастої або полочной насадкою і теплообмінник. Гази. проходячи через колону синтезу, реагують між собою; що виходить з колони газова суміш містить 15 - 20% аміаку. Далі ці гази надходять в конденсатор 6, де і відбувається зріджування аміаку Рідкий аміак відділяється в сепараторі 7 і надходить в резервуар 9, а не прореагували гази подаються циркуляційним насосом 8 у фільтр 1 для змішування зі свіжої азото-водневої сумішшю.
Аміак використовується для отримання азотної кислоти. азотовмісних солей. сечовини. синильної кислоти. соди аміачним методом. Так як рідкий аміак має велику теплоту випаровування. то. він служить робочою речовиною холодильних машин. Рідкий аміак і його водні розчини застосовують як рідкі добрива. Великі кількості аміаку йдуть на аммонізаціей суперфосфату і тукових сумішей.
Аміак отруйний. Він сильно дратує слизисті оболонки. Гостре отруєння аміаком викликає ураження очей і дихальних шляхів, задишку, запалення легенів. Гранично допустимою концентрацією аміаку в повітрі виробничих приміщень вважається 0,02 г / м 3. Аміак зберігають в сталевих балонах. забарвлених в жовтий колір, з чорним написом - аміак.
Літ. Технологія зв'язаного азоту. М. тисячу дев'ятсот шістьдесят шість.
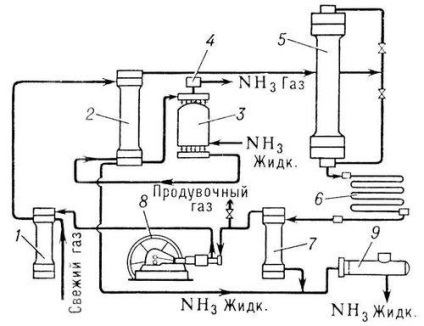
Агрегат синтезу аміаку (технологічна схема).
