Речовини, що містять в молекулі одну або декілька карбоксильних груп, називаються карбоновими кислотами.
O
//
Група атомів С називається карбоксильною групою або карбоксилом.
# 92;
OH
Органічні кислоти, що містять в молекулі одну карбоксильну групу, є одноосновними. Загальна формула цих кислот RCOOН.
Карбонові кислоти, що містять дві карбоксильні групи, називаються двохосновні. До них відносяться, наприклад, щавлева і бурштинова кислоти.
Існують і багатоосновні карбонові кислоти, що містять більше двох карбоксильних груп. До них відноситься, наприклад, триосновна лимонна кислота. Залежно від природи вуглеводневого радикала карбонові кислоти діляться на граничні, неграничні, ароматичні.
Граничними, або насиченими, карбоновими кислотами є, наприклад, пропановая (пропіонова) кислота або вже знайома нам бурштинова кислота.
Номенклатура і ізомерія
Назва карбонової кислоти утворюється від назви відповідного алкана (алкана з тим же числом атомів вуглецю в молекулі) з додаванням суфікса -ов, закінчення -а і слова кислота. Нумерація атомів вуглецю починається з карбоксильної групи. наприклад:
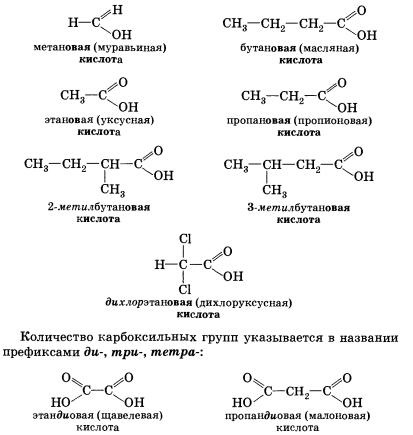
Багато кислоти мають і історично сформовані, або тривіальні, назви (табл. 6).
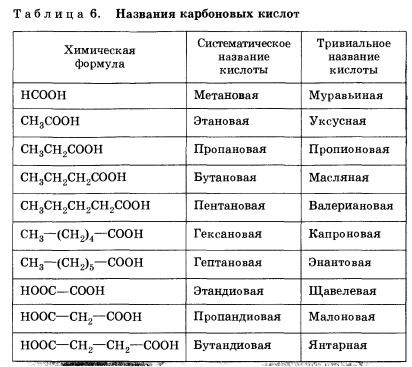
Склад граничних одноосновних кислот буде відображатися загальною формулою Сn Н2N O2, або Сn Н2N + 1 CООН, або RСООН.
Фізичні властивості насичених одноосновних карбонових кислот
Нижчі кислоти, т. Е. Кислоти з відносно невеликою молекулярною масою, що містять в молекулі до чотирьох атомів вуглецю, - рідини з характерним різким запахом (згадайте запах оцтової кислоти). Кислоти, що містять від 4 до 9 атомів вуглецю, - в'язкі маслянисті рідини з неприємним запахом; містять більше 9 атомів вуглецю в молекулі - тверді речовини, які не розчиняються у воді. Температури кипіння граничних одноосновних карбоно-вих кислот збільшуються з ростом числа атомів вуглецю в молекулі і, отже, до зростання відносної молекулярної маси. Так, наприклад, температура кипіння мурашиної кислоти дорівнює 101 ° С, оцтової - 118 ° С, пропіонової - 141 ° С.
Найпростіша карбонова кислота - мурашина НСООН. маючи невелику відносну молекулярну масу (46), при звичайних умовах є рідиною з температурою кипіння 100,8 ° С. У той же час бутан (МR (С4Н10) = 58) в тих же умовах газообразующую і має температуру кипіння -0,5 ° С. Ця невідповідність температур кипіння і відносних молекулярних мас пояснюється утворенням димерів карбонових кислот, в яких дві молекули кислоти пов'язані двома водневими зв'язками. Виникнення водневих зв'язків стає зрозумілим при розгляді будови молекул карбонових кислот.
Мурашина і оцтова кислоти розчинні у воді необмежено. Очевидно, що зі збільшенням числа атомів в вуглеводневому радикала розчинність карбонових кислот знижується.
Загальні властивості, характерні для класу кислот (як органічних, так і неорганічних), обумовлені наявністю в молекулах гідроксильної групи, що містить сильно полярну зв'язок між атомами водню і кисню.
1. Дисоціація з утворенням катіонів водню і аніонів кислотного залишку.
Рівновага дисоціації карбонових кислот зміщене вліво, переважна більшість їх - слабкі електроліти. Тим не менш кислий смак, наприклад, мурашиної і оцтової кислот пояснюється дисоціацією на катіони водню і аніони кислотних залишків.
Очевидно, що присутністю в молекулах карбонових кислот «кислого» водню, т. Е. Водню карбоксильної групи, обумовлені і інші характерні властивості.
2. Взаємодія з металами, що стоять в електрохімічному ряді напруг до водню. Так, залізо відновлює водень з оцтової кислоти:
2СН3-СООН + Fe -> (CHgCOO) 2Fe + Н2
3. Взаємодія з основними оксидами з утворенням солі і води:
2R-СООН + СаО -> (R-СОО) 2Са + Н20
4. Взаємодія з гідроксидами металів з утворенням солі і води (реакція нейтралізації):
R-СООН + NaOH -> R-COONa + Н20 3R-СООН + Са (ОН) 2 -> (R-СОО) 2Са + 2Н20
5. Взаємодія з солями слабших кислот, з утворенням останніх. Так, оцтова кислота витісняє стеаринову з стеарат натрію і вугільну з карбонату калію.
6. Взаємодія карбонових кислот зі спиртами з утворенням складних ефірів - вже відома вам реакція ете-ріфікаціі (одна з найбільш важливих реакцій, характерних для карбонових кислот). Взаємодія карбонових кислот зі спиртами каталізується катіонами водню.
Реакція етерифікації оборотна. Рівновага зміщується в бік утворення складного ефіру в присутності водоотні-мающих засобів і видаленні ефіру з реакційної суміші.
В реакції, зворотної етерифікації, яка називається гідролізом складного ефіру (взаємодія складного ефіру з водою), утворюються кислота і спирт. Очевидно, що реагувати з карбоновими кислотами, т. Е. Вступати в реакцію етерифікації, можуть і багатоатомні спирти, наприклад гліцерин:
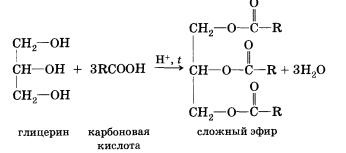
Всі карбонові кислоти (крім мурашиної) поряд з карбоксильною групою містять в молекулах вуглеводневий залишок. Безумовно, це не може не позначитися на властивостях кислот, які визначаються характером вуглеводневої залишку.
7. Реакції приєднання по кратному зв'язку - в них вступають ненасичені карбонові кислоти; наприклад, реакція приєднання водню - гідрування. При гідруванні олеїнової кислоти утворюється гранична стеаринова кислота.
Ненасичені карбонові кислоти, як і інші ненасичені сполуки, приєднують галогени за подвійним зв'язком. Так, наприклад, акрилова кислота знебарвлює бромную воду.
8. Реакції заміщення (з галогенами) - в неї здатні вступати граничні карбонові кислоти; наприклад, при взаємодії оцтової кислоти з хлором можуть бути отримані різні хлорпохідні кислоти:
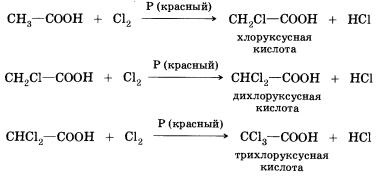
При Галогенування карбонових кислот, що містять більше одного атома вуглецю в вуглеводневому залишку, можливе утворення продуктів з різним становищем галогену в молекулі. При протіканні реакції по свободнорадикальному механізму можуть заміщатися будь атоми водню в вуглеводневому залишку. Якщо ж реакцію проводити в присутності невеликих кількостей червоного фосфору. то вона йде селективно - водень заміщається лише в а-положенні (у найближчого до функціональної групі атома вуглецю) в молекулі кислоти. Причини такої селективності ви дізнаєтеся при вивченні хімії в вищому навчальному закладі.
Карбонові кислоти утворюють різні функціональні похідні при заміщенні гідроксильної групи. При гідролізі цих похідних з них знову утворюється карбонова кислота.
Карбонові кислоти можуть бути отримані окислюванням первинних спиртів і альдегідів.
Ароматичні карбонові кислоти утворюються при окисленні гомологів бензолу.
Гідроліз різних похідних карбонових кислот також призводить до отримання кислот. Так, при гідролізі складного ефіру утворюються спирт і карбонова кислота. Як вже говорилося вище, реакції етерифікації і гідролізу, катарілізіруемие кислотою, оборотні. Гідроліз складного ефіру під дією водного розчину лугу протікає необоротно, в цьому випадку зі складного ефіру утворюється не кислота, а її сіль. При гідролізі нітрилів спочатку утворюються аміди, які потім перетворюються в кислоти. Карбонові кислоти утворюються при взаємодії магній-органічних сполук з оксидом вуглецю (IV).
Окремі представники карбонових кислот і їх значення
Мурашина (метанова) кислота НСООН - рідина з різким запахом і температурою кипіння 100,8 ° С, добре розчинна у воді. Мурашина кислота отруйна, при попаданні на шкіру викликає опіки! Жалить рідина, що виділяється мурахами, містить цю кислоту. Мурашина кислота володіє дезинфікуючим властивістю і тому знаходить своє застосування в харчовій, шкіряної і фармацевтичної промисловості, медицині. Вона також використовується при фарбуванні тканин і паперу.
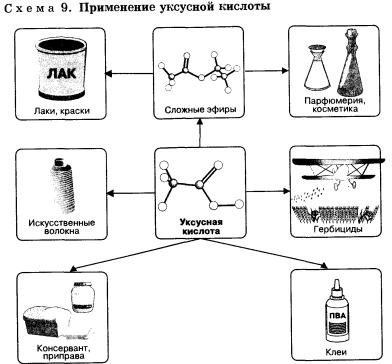
Оцтова (метанова) кислота СН3СООН - безбарвна рідина з характерним різким запахом, змішується з водою в будь-яких відносинах. Водні розчини оцтової кислоти надходять у продаж під назвою оцту (3-5% -ний розчин) і оцтової есенції (70-80% -ний розчин) і широко використовуються в харчовій промисловості. Оцтова кислота - хороший розчинник багатьох органічних речовин і тому використовується при фарбуванні, в шкіряному виробництві, в лакофарбової промисловості. Крім цього, оцтова кислота є сировиною для отримання багатьох важливих в технічному відношенні органічних сполук: наприклад, на її основі отримують речовини, використовувані для боротьби з бур'янами, - гербіциди.
Оцтова кислота є основним компонентом винного оцту, характерний запах якого обумовлений саме їй. Вона продукт окислення етанолу і утворюється з нього при зберіганні вина на повітрі.
Найважливішими представниками вищих граничних одноосновних кислот є пальмітинова С15Н31СООН і стеаринова С17Н35СООН кислоти. На відміну від нижчих кислот ці речовини тверді, погано розчинні у воді.
Однак їх солі - стеарати і пальмітат - добре розчинні і володіють миючим дією, тому їх ще називають милами. Зрозуміло, що ці речовини роблять у великих масштабах.
З ненасичених вищих карбонових кислот найбільше значення має олеїнова кислота С17Н33СООН, або (СН2) 7СООН. Це маслоподоб-ва рідина без смаку і запаху. Широке застосування в техніці знаходять її солі.
Найпростішим представником двоосновних карбонових кислот є щавлева (етандіовая) кислота ноос-СООН, солі якої зустрічаються в багатьох рослинах, наприклад в щавлі і Кислиці. Щавлева кислота - це безбарвна кристалічна речовина, добре розчиняється у воді. Вона застосовується при поліровці металів, у деревообробній і шкіряної промисловості.
1. неграничними елаідіновая кислота С17Н33СООН є транс-ізомером олеїнової кислоти. Складіть структурну формулу цієї речовини.
2. Складіть рівняння реакції гідрування олеїнової кислоти. Назвіть продукт цієї реакції.
3. Складіть рівняння реакції горіння стеаринової кислоти. Який об'єм кисню і повітря (н. У.) Буде потрібно для спалювання 568 г стеаринової кислоти?
4. Суміш твердих жирних кислот - пальмітинової і стеаринової - називають стеарином (саме з нього виготовляють стеаринові свічки).
Який обсяг повітря (н. У.) Буде потрібно для спалювання двохсотграмових стеаринової свічки, якщо стеарин містить рівні маси пальмітинової і стеаринової кислот? Який обсяг вуглекислого газу (н. У.) І маса води утворюються при цьому?
5. Вирішіть попередню задачу за умови, що свічка містить рівні кількості (однакове число молей) стеаринової і пальмітинової кислот.
6. Для видалення плям іржі їх обробляють розчином оцтової кислоти. Складіть молекулярні та іонні рівняння відбуваються при цьому реакцій, враховуючи, що іржа містить оксид і гідроксид заліза (III) - Fе2O3 і Fе (ОН) 3.
Чому такі плями не видаляються водою? Чому вони зникають при обробці розчином кислоти?
7. Додаємо в бездріжджове тісто харчову (питну) соду МаНС03 попередньо «гасять» оцтовою кислотою. Виконайте будинку цю реакцію і складіть її рівняння, знаючи, що вугільна кислота слабкіше оцтової. Поясніть утворення піни.
8. Знаючи, що хлор більш електроотріцателен, ніж вуглець. розташуйте такі кислоти: оцтову, пропіоніл-ву, хлоруксусную, діхлоруксусной і трихлоруксусную кислоти в порядку посилення кислотних властивостей. Обгрунтуйте свою результат.
9. Чим можна пояснити, що мурашина кислота вступає в реакцію «срібного дзеркала»? Складіть рівняння цієї реакції. Який газ може виділятися при цьому?
10. При взаємодії 3 г граничної одноосновної карбо-нової кислоти з надлишком магнію виділилося 560 мл (н. У.) Водню. Визначте формулу кислоти.
11. Наведіть рівняння реакції, за допомогою яких можна описати хімічні властивості оцтової кислоти. Назвіть продукти цих реакцій.
12. Запропонуйте нескладний лабораторний спосіб, за допомогою якого можна розпізнати пропановий і акрилову кислоти.
13. Складіть рівняння реакції отримання метилформиата - складного ефіру метанолу та мурашиної кислоти. В яких умовах слід проводити цю реакцію?
14. Складіть структурні формули речовин, що мають склад С3Н602. До яких класів речовин їх можна віднести? Наведіть рівняння реакцій, характерних для кожного з них.
15. Речовина А - ізомер оцтової кислоти - не розчиняється у воді, проте може піддаватися гідролізу. Яка структурна формула речовини А? Назвіть продукти його гідролізу.
16. Складіть структурні формули наступних речовин: а) метилацетат; б) щавлева кислота;
в) мурашина кислота; г) діхлоруксусной кислота; д) ацетат магнію; е) етилацетат; ж) етілформіат; з) акрилова кислота.
17 *. Зразок граничної одноосновної органічної кислоти масою 3,7 г нейтралізували водним розчином бікарбонату натрію. При пропущенні газу, що виділився через вапняну воду було отримано 5,0 г осаду. Яка кислота була взята і який обсяг газу, що виділився?