Теоретична частина . Синтетичні полімери отримують шляхом полімеризації або поліконденсації.
Полімеризація - реакція сполуки кількох молекул, при якій не виходять і не виділяються побічні продукти, а ланки утворює полімеру і мономер мають однаковий елементний склад або іншими словами полімеризація є приєднання невеликих за розміром молекул мономера (за рахунок кратних зв'язків або розкриття циклу) до утворюється довго-ланцюгової полімерної молекулі, званої макромолекулою. У загальному вигляді процес полімеризації можна зобразити схемою:
де M - молекула мономера, M '- мономерна ланка макромолекули, n - число ланок в полімерного ланцюга.
Хімічна природа повторюваних ланок і ступінь полімеризації визначають властивості полімеру. Полімеризація неграничних мономерів протікає за законами ланцюгових реакцій. Здатність до ланцюгової полімеризації є характерним властивістю дієнових і вінілових з'єднань. Обумовлюється це наявністю в молекулі цих сполук подвійних зв'язків. Оскільки енергія π-зв'язку приблизно дорівнює 218 кДж / моль, а α-зв'язку - близько 353 кДж / моль, то π-зв'язок є більш реакційно. Тому полімеризація відбувається при розриві π-зв'язку.
Властивості еластомерів залежать не тільки від виду мономера, але і від характеру і умов поляризації.
Процес полімеризації складається з трьох стадій:
Ініціювання - утворення активного центру A → A *;
Зростання ланцюга A * + A → AA * → An + 1 A * і тд .;
Окремі стадії ланцюгової полімеризації розрізняються за швидкістю і тепловим ефектом. Енергія активації освіти активного центру велика, і реакція протікає з відносно малою швидкістю.
Особливості процесу ланцюгової полімеризації визначаються характером активного центру (катіоном, аніоном, координаційним центром).
Розрізняють два типу полімеризації: вільно-радикальну і іонну (катіонну, аніонну, іонно-координаційну).
Іонна полімеризація, порушується сполуками, здатними утворювати в вуглеводневої середовищі іони, має виняткову селективність відносно мономерів і характеризується рядом особливостей і переваг:
Сильно залежить від полярності розчинника;
Протікає з великими швидкостями і значно меншою енергією активації;
Полімеризація може здійснюватися при температурах, що доходять до -100 ° C.
Низька температура, висока швидкість полімеризації і орієнтують дія активного центру каталізатора на молекули мономера призводять до того, що ці молекули з'єднуються один з одним в певному порядку і тим самим можуть утворювати:
Полімери з високою молекулярною маси і порівняно вузького молекулярно масового розподілу.
Схематично катіонну (на прикладі стиролу) можна представити таким чином:
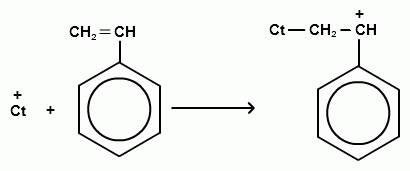
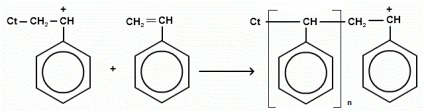
Каталізаторами катионной полімеризації є сильні електроноакцепторні речовини:
Каталізатори Фріделя-Крафтса - BF3, AlCl3, SnCl4, TiCl4, SbCl5, і ін .;
Водневі кислоти - H2SO4, HCl, H3PO4, і ін .;
Інші кислоти - I2, ICl, IBr, і ін.
За активністю каталізатори розташовуються в ряд:
BF3 Найчастіше застосовують TiCl4, AlCl3, SnCl4, BF3. Каталітична активність цих сполук значно підвищується, якщо в полімеризується системі у вигляді домішок містяться вода, галогенводородних кислоти, алкілгалогеніду і інші протонсодержащіе речовини. Іонні процеси мають високу чутливість по відношенню до води і різних домішок, що знаходяться в реакційній системі. Таким чином, вода і деякі інші речовини виконують роль співкаталізатор. Найбільш ефективні співкаталізатор поділяються на два види: З'єднання, легко віддають протони - вода, спирти, водневі кислоти; З'єднання типу галоїдних алкіл, що володіють здатністю утворювати карбонієвого катіони. Особливості кінетики катионной полімеризації полягають у тому, що: Сумарна швидкість полімеризації прямо пропорційна квадрату концентрацій мономеру і першого ступеня концентрації каталізатора; Ступінь полімеризації прямо пропорційна 1-го ступеня концентрації мономера і не залежить від концентрації каталізатора; Загальна енергія активації залежить, в тому числі від температури - чим вона нижча, тим вище швидкість полімеризації. Вплив розчинників: Швидкість і ступінь полімеризації підвищуються зі збільшенням величини діелектричної проникності розчинника, і не залежать так само від природи розчинника. Мета роботи: Отримання полістиролу шляхом блочної полімеризації стиролу під дією каталізатора катіонного типу і виділення його з реакційної системи осадженням. Реактиви. Стирол, гідроксид натрію, тетрахлорид олова, дихлоретан, ізопропанол, що охолоджує суміш (лід з кухонною сіллю). Прилади і посуд: Конічні колби з притертою пробкою на 50 мл, делительная воронка, скляні ампули, порцелянова чашка, посудину Дьюара, скляна паличка. Хід роботи: Змішуємо в скляній ампулі 4 мл стиролу і 2 мл каталізатора (1 мл SnCl4 в 30 мл дихлоретану). Розміщуємо ампулу в посудину Дьюара (в охолоджуючу суміш з температурою -20 ° С). Проводимо полімеризацію протягом 15 хвилин. Після закінчення 15 хвилин суміш загусає і її потрібно перемістити в порцелянову чашечку з ізопропанолом, де відбувається осадження полімеру. Зливаємо першу порцію осадителя, і додаємо ще невелика кількість изопропанола що б промити речовина. Зливаємо весь изопропанол і віджимаємо полімер тонким шаром по дну чашки. Ми залишаємо його сушитися на повітрі під витяжною шафою. Ініціація: Каталізатор утворює з домішками комплексні сполуки діссоцііруя на іони: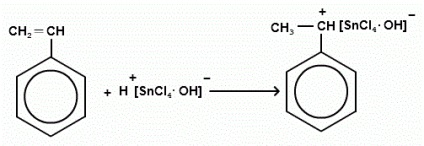
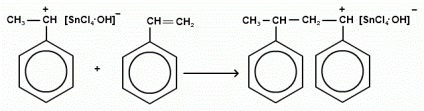
Обрив ланцюга: припинення росту ланцюга полягає в приєднанні до карбониевому макроіонів негативного іона каталізатора.
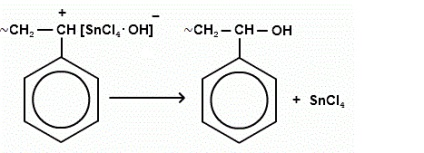
припинення росту ланцюга частіше пов'язане з відривом негативним іоном каталізатора водню від полімерного ланцюга.
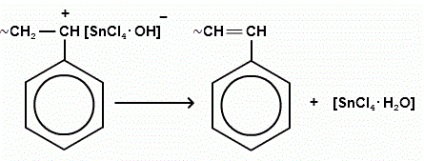
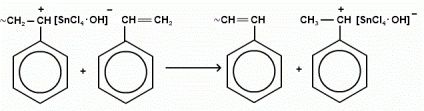
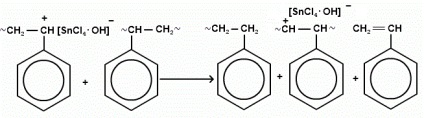
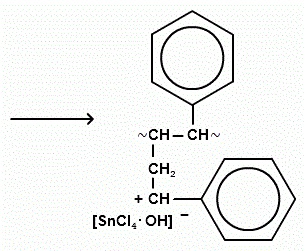
Маса отриманого полімеру:
Маса теоретичного полімеру:
Розрахунок ступеня перетворення:
Розрахунок виходу реакції: