
Головна | Про нас | Зворотній зв'язок
Питома електропровідність залежить від багатьох факторів. Це не дозволяє отримувати порівнянні та відтворювані результати. Тому краще користуватися еквівалентної електропровідністю, віднесеної до 1 кг-екв речовини.
Знайдемо зв'язок між питомою (# 967;) і еквівалентної електропровідністю (# 955;). Уявімо собі високий призматичний посудину з квадратною основою площею 1м 2. дві стінки якого являють собою платинові (Рt) електроди, а дві стінки - скляні. Наллємо в посудину електроліт на висоту 1м, при цьому загальна електропровідність буде рівна питомій. W = # 967;
Збільшуючи обсяг розчину, отримаємо: W = 2 # 967 ;;
і, нарешті, W = V × # 967 ;,
де V-об'єм розчину, в якому міститься 1кг-екв електроліту.
У цьому випадку загальна електропровідність дорівнює еквівалентній електропровідності: W = # 955; v.
І тоді: # 955; v = V × # 967 ;. (6)
Еквівалентної електропровідністю називається провідність стовпа розчину, що містить 1 кг-екв електроліту, укладеного між електродами, що знаходяться один від одного на відстані в 1м.
Число м 3 розчину, в якому міститься 1кг-екв розчиненої речовини називається розведенням розчину.
Розмірність еквівалентної електропровідності ( # 955; v): [Див × м 2 кг-екв -1], [Cм × м 2 × кг-екв -1]
Розведення - величина зворотна концентрації:
В системі СІ: [Cм × м 2 × кг-екв -1]
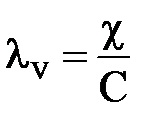
В системі СГС: [Cм × см 2 × г-екв -1]
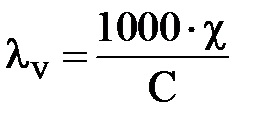
При розведенні розчину еквівалентна електропровідність може тільки зростати, т. К. При розведенні збільшується ступінь дисоціації, а при досягненні # 945; = 1, подальше розбавлення вже не може збільшити дисоціацію і еквівалентна електропровідність залишається величиною постійною, тобто вона прагне до граничного значення (l∞.). (Див. Рис.4).
Граничне значення еквівалентної електропровідності при ступеня дисоціації # 945; = 1 називаетсяеквівалентной електропровідністю при нескінченному розведенні.
Ставлення визначає частку продіссоцііровавшіх молекул.
Для сильних електролітів ця величина називається коефіцієнтом електричної провідності і визначається за формулою:
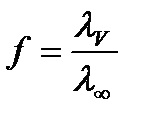
А для слабких електролітів - ступенем дисоціації і розраховується за формулою
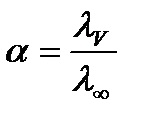
Еквівалентна електропровідність при нескінченному розведенні (l∞) розрахується за законом Кольрауша:
Еквівалентна електропровідність іонів при нескінченному розведенні є табличній величиною. Для розчину сильного електроліту l∞ знаходять за графіком:. Її знаходять екстраполяцією графіка при великому розведенні.
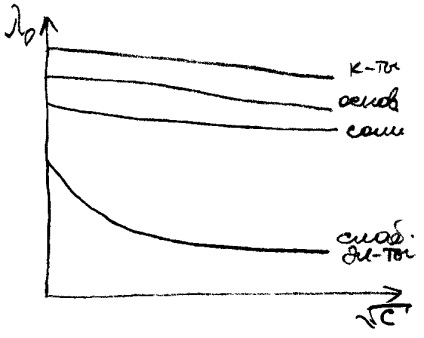
Завдяки електростатичному впливу іонів один на одного ефективна концентрація в розчині менше розрахункової і мірою відхилення є ступінь дисоціації або коефіцієнт електричної провідності.
Дисоціація слабких електролітів - це оборотний процес. При будь-якій температурі в розчині слабкого електроліту знаходяться катіони, аніони і молекули.
Розглянемо дисоціацію слабкого електроліту на прикладі оцтової кислоти:
Визначаємо константу дисоціації за формулою:
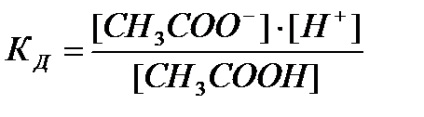
Припустимо, що в V мл розчину міститься а моль речовини оцтової кислоти (CH3 COOH), тоді вихідна концентрація оцтової кислоти дорівнює:.
Позначимо через х - число молей CH3 COOH, що розпалися на іони, тоді число іонів дорівнюватиме:
.
Число непродіссоцііровавшіх молекул визначиться як:
звідси константа рівноваги дорівнює:
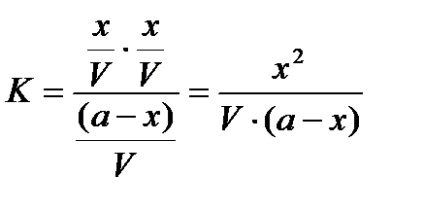
Позначимо «Х» через «a». . тоді:
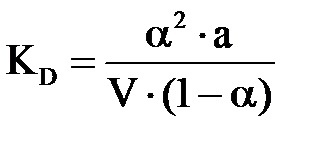
Враховуючи що

Ддля слабких електролітів a ← 0, тоді знаменник приблизно дорівнює 1, і спрощена форма закону розведення Оствальда матиме вигляд:
Кб = a 2 × C (11)
Знаходимо звідси ступінь дисоціації:
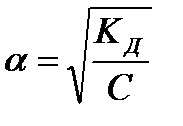
Ступінь дисоціації змінюється обернено пропорційно кореню квадратному з концентрації. Так при зменшенні концентрації в 100 разів, ступінь дисоціації зросте в 10 разів.
