ЕЛЕКТРОННІ ЕФЕКТИ В МОЛЕКУЛАХ органічних сполук.
Електронні ефекти - зміщення електронної густини в молекулі,
йоні або радикал під впливом заступників.
Заступником вважається будь-який атом (крім водню) або група атомів.
пов'язана з атомом вуглецю.
Розрізняють індуктивний і мезомерний електронні ефекти заступників.
Індуктивний ефект (I-еффeкт) - зміщення електронної густини по ланцюгу
s -зв'язків, обумовлене відмінностями в електронний торгівельний атомів.
Через слабку поляризуемости s -зв'язків I - ефект швидко згасає з віддаленням від
заступника і через 3-4 зв'язку стає практично рівним 0.
Індуктивний ефект називають негативним (- I), якщо заступник зменшує
електронну щільність на атомі вуглецю, з яким пов'язаний цей заступник.
При цьому заступник набуває частковий негативний заряд (d-), а атом
вуглецю - частковий позитивний заряд (d +). напрямок зміщення
електронної щільності всіх s -зв'язків позначається прямими стрілками
(По лінії зв'язку) і символами часткових зарядів, індукованих заступником.
H3C d + ® Cl d - (- I - ефект атома хлору)
-I-ефект виявляють заступники, які містять більш електронегативний
Індуктивний ефект називають позитивним (+ I). якщо заступник
збільшує електронну щільність на атомі вуглецю, індукуючи на ньому
частковий негативний заряд (d-), сам при цьому набуваючи заряд d +.
Приклад: H3C d - Li d + (+ I - ефект атома літію)
Мезомерний ефект (М-ефект) - зміщення електронної густини по ланцюгу
делокалізованних (пов'язаних) p -зв'язків (див. розділ 4.10). цей ефект
проявляють заступники, пов'язані з sp 2 - або sp - гібрідізоваться атомом.
Завдяки рухливості p-електронів, М-ефект передається по ланцюгу сполучення
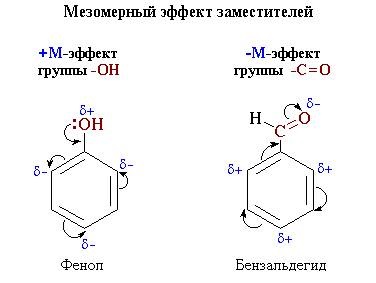
+М-ефектом володіють заступники, які підвищують електронну щільність в
сполученої системі. До них відносяться групи, які містять атоми з
неподіленої парою електронів, здатні до передачі цієї пари електронів в
загальну систему сполучення. + М-ефект характерний для груп -OH і -NH2
-М-ефект виявляють заступники з електронегативними атомами і
зміщують електронну щільність на себе. - М-ефект характерний для груп
-CH = O. -COOH. -NO2. Хоча ці групи мають неподіленого електронні пари,
просторове розташування орбіталей з цими електронами не дозволяє
їм вступати в систему сполучення. Таким чином, в даному випадку заступник
може лише відтягувати електрони із загальної системи сполучення за рахунок своєї
більш високою електронегативності.
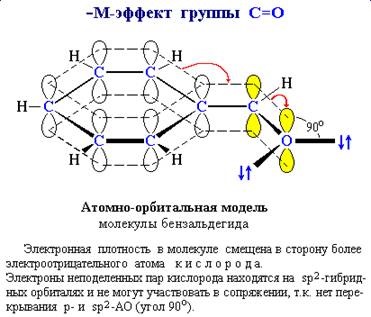
Для визначення знака М-ефекту корисно будувати атомно-орбітальні моделі.
відбивають просторову орієнтацію орбіталей і можливості їх
перекривання (див. розділ 4.9). Так, якщо p орбіталь кратному зв'язку C = O і
sp 2 - орбіталі з неподіленими парами електронів атома кисню
розташовані перпендикулярно один одному, то їх перекривання неможливо і
жодна електронна пара кисню не може передаватися в p-систему.
Отже, заступник, який містить групу C = O. виявляє не + М.
а - М-ефект (ріс_6_4_1.
Напрямок зміщення електронної густини під впливом М -ефекту
позначається вигнутими стрілками (ріс_6_4_2).