Електронні ефекти - зміщення електронної густини в молекулі, йоні або радикал під впливом заступників.
Заступником вважається будь-який атом (крім водню) або група атомів, пов'язана з атомом вуглецю.
Розрізняють індуктивний і мезомерний електронні ефекти заступників.


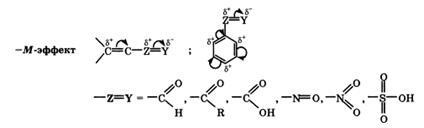
+М-ефект характерний для груп -OH і -NH2. -М-ефект виявляють заступники з електронегативними атомами і зміщують електронну щільність на себе. -М-ефект характерний для груп -CH = O, -COOH, -NO2. Хоча ці групи мають неподіленого електронні пари, просторове розташування орбіталей з цими електронами не дозволяє їм вступати в систему сполучення. Таким чином, в даному випадку заступник може лише відтягувати електрони із загальної системи сполучення за рахунок своєї більш високої електронегативності.
Кислотність і основність органічних сполук.
Для оцінки кислотності і основності органічних сполук найбільше значення мають дві теорії - теорія Бренстеда і теорія Льюїса.
За теорією Льюїса кислотні та основ-ні властивості з'єднань визначаються їх здатністю приймати або віддавати пару електронів з утворенням зв'язку. Відповідно до принципу ЖМКО кислоти і підстави Льюїса діляться на жорсткі і м'які.
Кислотами Льюїса можуть бути атоми, молекули або катіони, що володіють вакантної орбиталью і здатні приймати пару електронів з утворенням ковалентного зв'язку.
Кислоти Льюїса - акцептори пари електронів; підстави Льюїса - донори пари електронів. Підстави Льюїса (атом, молекула або аніон) повинні володіти принаймні однією парою валентних електронів, яку вони здатні надати партнеру для утворення ковалентного зв'язку. Всі підстави Льюїса є нуклеофільниє реагенти.
За теорією Бренстеда (Протолітична теорії) кислотність і основність сполук зв'язується з переносом протона Н +. Кислота і підстава утворюють сполучену кислотно-основну пару, в якій чим сильніше кислота, тим слабкіше пов'язаний-ве їй підставу, і навпаки, чим сильніше підставу, тим слабкіше сполучена йому кислота.
Кислоти Бренстеда (протонні кислоти) - нейтральні молекули або іони, здатні віддавати протон (донори протонів).
Підстави Бренстеда - нейтральні молекули або іони, здатні приєднувати протон (акцептори протонів).
Кислотність і основність не є абсолютними, а відносними властивостями сполук: кислотні властивості виявляються лише в присутності основи; основні властивості - тільки в присутності кислоти. Як розчинник при вивченні кислотно-основних рівноваг зазвичай використовується вода.
Залежно від природи елемента, з яким пов'язаний про-тон, розрізняють ОН кислоти (карбонові кислоти, феноли, спирти), SH-кислоти (Меркаптани), N Н-кислоти (аміни, аміди, іміди), СН-кислоти (вуглеводні і їх вироб-водні). Елемент і пов'язаний з ним атом водню називають кислотним центром. У всіх випадках присутня зрушення електронної щільності від атома водню до більш електронегативного атома, протона більш-менш легко отщепа. Чим вище електронний торгівельний елемента, з яким пов'язаний протон, тим більше кислотність з'єднання (так, карбонові кислоти є більш сильними кислотами, ніж Меркаптани або аміни).
Наявність в молекулі електроноакцепторних груп, що володіють негативними електронними ефектами, збільшує позитивний заряд на протоні, що призводить до посилення кислотних властивостей.
Для утворення ковалентного зв'язку з протоном підстави Бренстеда повинні надавати або неподіленого пару електронів, або електрони p-зв'язку. У соот-но до цим підстави Бренстеда діляться на п -підстави і p-підстави.
n -підстави можуть бути нейтральними або негативно за-рядженими. Як правило, аніони мають більш сильно Вира-женним основним характером, ніж нейтральні речовини. Тобто амід-іон NН2 - або гідроксид-іон НО - по основності перевершують аміак NН3 і воду Н2 О.
В p-підставах, до яких відносяться алкени, алкадіени, арени, центром основності, тобто місцем приєднання протона, є електрони p-зв'язку. Це дуже слабкі підстави, так як протоніруемие електронні пари невільні.
Наявність електронодонорні заступників збільшує основність органічних сполук.
1. Залежність кислотності від гетероатома.
Під природою гетероатома розуміють його електронегативність (Е.О.) і поляризованість. Чим більше (Е.О.) тим легше здійснюється гетеролітичною розрив в молекулі. У періодах зліва направо з ростом заряду ядра зростає (Е.О), тобто здатність елементів утримувати негативний заряд. В результаті зсуву електронної щільності зв'язок між атомами поляризується. Чим більше електронів і чим більше радіус атома, тим далі електрони зовнішнього енергетичного рівня розташовані від ядра, тим вище здатність до поляризації і вище кислотність.
Приклад: СН- NH- OH- SH-
збільшення Е.О. і кислотності
З, N, О - елементи одного періоду. Е.О. по періоду зростає, кислотність збільшується. В цьому випадку поляризованість впливати на кислотність не буде.
Поляризуемость атомів в періоді змінюється незначно, тому головним чинником визначальним кислотність є Е.О.
Тепер розглянемо ОН SH-
О, S - знаходяться в одній групі, радіус в групі зверху вниз збільшується, отже, зростає і поляризованість атома, що веде до збільшення кислотності. У S радіус атома більше, ніж у О, тому Меркаптани виявляють сильніші кислотні властивості в порівнянні зі спиртами.
2. Вплив вуглеводневого радикала і присутніх в ньому заступників
Електроноакцепторні (Е.А.) заступники сприяють делокализации електронної щільності, що веде до стабільності аниона і відповідно збільшення кислотності.
Електронодонорні (Е.Д.) заступники навпаки сприяють концентрації електронної щільності в кислотному центрі, що веде до зниження кислотності і збільшення основності.
Взаємодія молекул або іонів розчиненої речовини з розчинником називається процесом сольватації. Стабільність аниона істотно залежить від його сольватації в розчині: чим більше іон сольватованих, тим він стійкіший, а сольватация тим більше, чим менше розмір іона і чим менше делокализация в ньому негативного заряду.