Молекули складаються з однакових або різних атомів, з'єднаних між собою в одне ціле силами зв'язку, які називають хімічними зв'язками. Сили, що утримують атоми в молекулі, викликані взаємодією зовнішніх електронів.
Розрізняють два види зв'язку. Один з них здійснюється в тих молекулах, в яких частина зовнішніх електронів рухається навколо обох ядер (ми обмежимося розглядом тільки двоатомних молекул). Такий зв'язок називається гомеополярной або ковалентним зв'язком. До молекулам з таким зв'язком відносяться молекули з однаковими ядрами (Н2. N2. O2) і молекули з різними ядрами (наприклад, CN).
Другий тип зв'язку має місце в тому випадку, коли електрони в молекулі можна розділити на дві групи, кожна з яких весь час знаходиться близько одного з ядер. Електрони розподіляються так, що біля одного з ядер утворюється надлишок електронів, а біля іншого - їх недолік. Таким чином, молекула як би складається з двох іонів протилежних знаків, що притягуються один до одного. Цей тип зв'язку називається іонної або іонної. Прикладом молекулс іонним зв'язком можуть служити NaCl, KBr, HCl і т. Д.
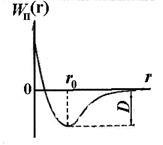
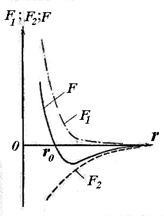
Незалежно від природи тих сил, які призводять до утворення стійкої системи з двох атомів можна висловити деякі загальні міркування про характер цих сил. Атоми, розташовані на значній відстані один від одного, не взаємодіють дуг з одним. У міру зменшення відстані r між ядрами атомів зростають сили взаємного тяжіння, що діють між атомами (див. Рис. 11.5, F2). Однак ці сили не є єдиними. На малих відстанях між атомами виявляють свою дію сили взаємного відштовхування F1. що не дозволяють електронам одного атома занадто глибоко проникнути всередину електронних оболонок іншого атома. Сили відштовхування є більш короткодіючими, ніж сили тяжіння. Завдяки одночасному дії протилежний спрямованих сил - тяжіння і відштовхування - на деякій відстані r0 між атомами обидві сили врівноважують один одного і їх геометрична сума (результуюча сила F) дорівнює нулю.
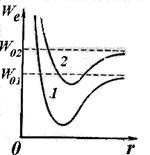
В основному зміна запасу енергії молекули відбувається, як і в атомі, в результаті зміни електронної конфігурації, що утворює периферичну частину молекули. При зміні електронної конфігурації (при порушенні молекули) зміщується крива залежності електронної енергії від відстані між ядрами (див. Криві 1 і 2 на рис. 11.7). При заданій електронної конфігурації атоми молекули можуть здійснювати коливальний рух відносно один одного і обертатися щодо загального центру інерції. Повну енергію будь-якого стаціонарного стану молекули можна представити у вигляді:
де We - енергія, обумовлена електронною конфігурацією, Wv - енергія коливального руху, Wr - енергія обертального руху.
Використовуючи рівняння квантової механіки, можна показати, що не тільки при зміні електронної конфігурації, але і при зміні енергії коливального і обертального рухів, енергія зазначених видів руху має дискретні значення і може бути виражені таким чином:
v = 0, 1, 2, 3, ...; # 969; v - циклічна частота коливань; J - обертальний квантове число, яке може набувати таких значень: J = 0, 1, 2, 3, ...; I - момент інерції молекули відносно осі, що проходить через центр інерції.
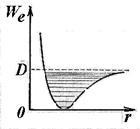
Формула (11.5) визначає енергію гармонійного осцилятора. У міру збільшення енергії коливань (збільшення квантового числа v) спостерігається ангармонічності, що веде до зближення рівнів коливального руху, маючи своїм межею енергію дисоціації молекули (рис. 11.8).
Отже, відповідно до (11.5) і (11.6) полнаяенергія молекули дорівнює:
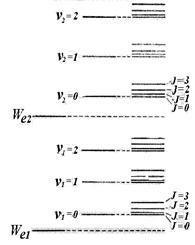
Досвід і теорія показують, що відстань між обертовими рівнями # 8710; Wr значно менше відстані між коливальними рівнями # 8710; Wv. яке в свою чергу значно менше, ніж відстань між електронними рівнями # 8710; Wе. Таким чином, схема енергетичних рівнів молекули виглядає так, як показано на ріс.11.9 (наведені тільки два електронних рівня). Сукупність рівнів міститься в правій колонці малюнка. Перші два стовпці лише пояснюють виникнення рівнів.
Молекулярні спектри сильно відрізняються від атомних. Атомні спектри складаються з окремих ліній,
молекулярні ж спектри складаються зі смуг, різких з одного краю і розмитих з іншого. При вивченні цих спектрів за допомогою приладів з великою роздільною здатністю визначають найважливіші фізичні характеристики молекул: довжину зв'язку, енергію зв'язку, момент інерції.