Відкритий урок по темі: "Історія відкриття будови атома"
"Знайди всьому початок і ти багато чого зрозумієш". (Козьма Прутков.)
Тип уроку: урок вивчення нового матеріалу.
Мета уроку: вивчити будову атома.
- Вивчити планетарну модель атома.
- Ознайомити учнів з гіпотезою Томсона і фундаментальним досвідом Резерфорда.
- Розглянути історію відкриття нейтрона і створення протонно-нейтронної моделі атома.
- Відпрацювати навички визначення складу атома, складу ядра атома по періодичній системі хімічних елементів.
- Продовжити розвиток навичок роботи з опорним конспектом, таблицями і схемами.
- Розвивати інтелектуальні та творчі здібності учнів.
- Розвивати монологічне мовлення.
- Формувати вміння самостійно працювати з різними джерелами, узагальнювати матеріал при підготовці проектів.
- Розвивати пізнавальний інтерес до предметів.
- Показати значення досвідчених фактів.
- Показати роль великих вчених у розвитку науки.
Обладнання: портрети вчених; таблиця періодичної системи хімічних елементів Д. І. Менделєєва; фільм "Досвід Резерфорда" (фрагмент); бланк опорного конспекту (у кожного учня).
- Вступне слово вчителя, постановка цілей уроку.
- Виклад нового матеріалу.
- Відпрацювання вивченого матеріалу.
- Підбиття підсумків. Домашнє завдання.
В історії розвитку фізики одна з найбільш цікавих і захоплюючих сторінок - це історія відкриття складної будови атома. В кінці XIX- початку XX ст. ідеї про будову атома витали в повітрі, різні припущення вчених створювали духовну атмосферу, в якій, врешті-решт, і народжувалося відкриття, адже в той час нічого про внутрішню будову атома не було відомо. Завдання нашого уроку - зробити екскурс в історію розвитку поглядів на будову атома, починаючи з давніх часів до початку 20-го століття, познайомитися з фундаментальними експериментами і теоретичними роботами кінця 19-го - початку 20-го століття, які перевернули уявлення про атом і привели до створення нової квантової моделі атома.
На хвилі відкриттів будови атома поет Валерій Брюсов в 1922 році написав чудовий вірш «Мир електрона»:
-Бути може, ці електрони-
Світи, де п'ять материків,
Мистецтва, знання, війни, трони
І пам'ять сорока століть.
-Ще можливо, кожен атом-
Всесвіт, де сто планет,
Там, все що тут, в обсязі стислому,
Але так само те, чого тут немає.
-Їх заходи малі, але все та ж
Їх нескінченність, як і тут
Там скорбота і пристрасть, як тут, і навіть,
Там та ж світова пиху.
Гіпотtза про існування атомів, тих неподільних частинок, різні конфігурації яких в порожнечі утворюють навколишній нас об'єктивний світ, так само стара, як і наша цивілізація. Поняття атома існує вже по край ній мері 25 століть.
Демокріт (460 - 370 рр. До нашої ери) - походив з багатого і знаменитого РДА в Північній Греції. Все що дісталися в спадок гроші він витратив на подорожі, де придбав великі знання. Городяни визнали його мудрецем.
Демокріт був переконаним атомісти. Основні елементи його картини природи такі:
- всі тіла складаються з атомів, які неподільні і мають незмінну форму;
- число атомів нескінченно, число різних типів атомів теж нескінченно;
-атоми мають різні виступами, заглибленнями, гачками, що дозволяє їм утворювати стійкі з'єднання;
-атоми знаходяться в постійному русі.
-Ось подивися: всякий раз, коли сонячне світло проникає
-В наші оселі і морок прорізає своїми променями,
-Безліч маленьких тел в порожнечі, ти побачиш, мелькаючи
- Метушаться взад і вперед в променистому сяйві світла;
-Нібито у вічній боротьбі вони б'ються в битвах і битвах,
-У сутичках кидаються раптом по загонах, не знаючи спокою.
-Може з цього ти виявиш себе, як невпинно
-Першооснови речей в порожнечі неосяжної метуть.
У Росії теорію про дрібні частинки речовини розвивав Михайло ВасільевічЛомоносов. Розрізняючи два види часток матерії, він дає їм назви «елементи» - атоми і «корпускули» - молекули.
«Елемент є частина тіла. яка не перебуває з будь-яких інших частинок, а «корпускула» є збори елементів в одну велику масу »
Так прозвучала думка про те, що молекула складається з атомів.
Однак до кінця 19-го століття з'являються неспростовні факти, які свідчать про складну будову атома. Найбільш серйозний удар по звичним уявленням про атомах завдало відкриття електрона - частки, що входить до складу атома і проведена після цього перша спроба створення моделі атома.
Отже Джозеф Джон Томсон
Проект представляє Смоленська Влада
Учень. Робить повідомлення про модель атома запропонованої англійським фізиком Дж. Дж. Томсоном: "Атом" в перекладі з грецького - неподільний. Але після відкриття в 1897 р електрона, що входить до складу атома, був зроблений висновок про складну будову атома. Перша досить розроблена модель атома була запропонована англійським фізиком Дж. Дж. Томсоном, який відкрив електрон. Відповідно до цієї моделі речовину в атомі несе позитивний заряд і рівномірно заповнює весь обсяг атома. Електрони "вкраплені" в атом. Передбачалося, що їх дуже багато. В цілому атом електронейтраллен. Для стійкості атома необхідно, щоб електрони розташовувалися концентричними шарами, в кожному шарі певне число електронів. Томсон за допомогою даної моделі пояснив ряд фізичних явищ. Наприклад, хороша провідність металів пояснювалася тим, що атоми металів легко втрачають частину електронів.
Перша модель атома зіграла позитивну роль: в подальшому була використана вірна ідея про шарах електронів в атомі, про втрату електронів атомами. Однак незабаром виявилося невідповідність моделі реальної дійсності. Зокрема, модель атома Томсона виявилася в протиріччі з результатами досвіду Резерфорда ".
Однак незабаром виявилося невідповідність даної моделі атома дійсності. Зокрема, модель атома Томсона виявилася в протиріччі з результатами дослідів Ернеста Резерфорда - одним із засновників, атомної та ядерної фізики, члена Лондонського королівського товариства, почесного члена 30 академій і наукових товариств, в тому числі Академії наук СССР.В 1908 році - лауреат Нобелівської премії за дослідження радіоактивності. Його учнями були Чедвік, Бор, Петро Капіца.
Петро Капіца писав: «Я не можу пригадати іншого вченого сучасника Резерфорда, в лабораторії якого виховувалося б стільки великих фізиків. Історія науки показує, що великий вчений - це не обов'язково велика людина, але великий вчитель не може не бути великою людиною! »
Проект представляє Іваночкіна Анна
Учень. Робить пояснення про планетарної моделі атома, яка витікає з дослідів Е. Резерфорда. У 1909 - 1911 рр. Резерфорд експериментально довів, що у атомів є ядра. У травні 1911 на сторінках лондонського "філософського журналу" він виклав результати експериментальних і теоретичних пошуків в області будови атома. Ядро займає в атомі незначну частину обсягу, воно позитивно заряджене, і в ньому зосереджена майже вся маса атома, так як електрони в порівнянні з атомом дуже легкі частинки. Електрони рухаються навколо ядра.
Альфа-частинки від радіоактивного джерела, пройшовши через діафрагму, потрапляють на тонку фольгу з золота. Вона має товщину близько мікрона, тобто складається приблизно з 3000 атомних шарів. Велика частина альфа-частинок легко проходить через фольгу, мало відхиляючись. Але деякі, рідкісні альфа-частинки відхиляються на значні кути і навіть на кути, близькі до 180 °, тобто відкидаються назад.
Результати досвіду можна пояснити наступним чином. Альфа-частинки, проходячи через фольгу, проходять крізь атоми золота. Це можливо тому, що легкі електрони майже не впливають на рух важкої альфа-частинки. Так як вони в більшості випадків відхиляються на малі кути, атоми в більшій частині свого об'єму заповнені електронами і лише невелику їх частину займає позитивно заряджену речовину. Ця центральна частина атома отримала назву ядра. З дослідів випливає, що ядро і відштовхує альфа-частинку, причому тим сильніше, чим ближче до ядра вона проходить. За співвідношенням між загальним числом частинок і числом відхилилися на певні кути частинок розраховується розмір ядра і заряд ядра. Виявилося, що радіус ядра має порядок 10 - 12 см (10 - 14 м). Заряд ж ядра позитивний і визначається формулою Q = Z • e, де Z - порядковий номер елемента в періодичній системі, а е-модуль заряду електрона.
1 Можливо, ці електрони-
Світи, де п'ять материків,
Мистецтва, знання, війни, трони
І пам'ять сорока століть.
2 Ще, можливо, кожен атом -
Всесвіт, де сто планет,
Там все, що тут, в обсязі стислому,
Але так само те, чого тут немає.
3 Їх заходи малі, але все та ж
Їх нескінченність, як і тут,
Там скорбота і пристрасть, як тут, і навіть
Там та ж світова пиху
4 Їх мудреці, свій світ безмежний
Поставивши центром буття,
Поспішають проникнути в іскри таємниці
І умствуют, як нині я
5 А в мить, коли з разрушенья
Творяться точки нових сил.
Кричать, в мріях самонавіювання.
Що Бог свій світоч загасив!
Термін «нейтрон» з'явився набагато раніше відкриття самої частки. Під ним розуміли якусь нейтральну структуру матерії. Ідея про існування нейтрона витала в повітрі і ніхто не знав яке обличчя він повинен прийняти.
Джеймс Чедвікполучіл Нобелівську премію за «відкриття нейтрона»
Свій проект являє Федосов Дмитро
Відкриття нейтрона - ключ до ядерної фізики. Поділ ядер урану під дією нейтрона «приголомшливе» і «зловісне» відкриття.
Значення відкриття атома досліджували Велігодський Дара і Дружина Дар'я
І на завершення хочу прочитати вам вірш, який написала учениця 10 класу Шульпіна Дар'я
Домашнє завдання з фізики: § 94. працюючи вдома з підручником, заповнити бланк опорного конспекту. Пропонуємо хлопцям за бажанням творче завдання (записано на дошці):
Скласти історію в будь-якому жанрі (казка, байка, детектив і т.д.): на що по-вашому схожий атом?

Історія відкриття будови атома

Демокріт (460 - 370 до н.е.)

Основні елементи його теорії будови атома
- Всі тіла складаються з атомів, які неподільні і мають незмінну форму
- Число атомів нескінченно
- Атоми мають різні виступами, заглибленнями, гачками, що дозволяє їм утворити стійкі сполуки
- Атоми перебувають у постійному русі

«Елемент є частина тіла, яка не перебуває з кількості інших менших частинок», а «корпускула є зібрання елементів в одну невелику масу.»

Модель атома «Пудинг з Ізюмом»

Математик Приходить в Фізику
- Досліджував проходження електричного струму через розріджені гази
- Відкрив (1897) електрон і визначив (1898) його заряд
- Запропонував (1903) одну з перших моделей атома
- Досліджував електричний струм в розріджених газах
- Пояснив безперервність спектра рентгенівських променів
- Висунув ідею про існування ізотопів і отримав її експериментальне підтвердження
- Один з творців електронної теорії металів

- У 1882 р удостоєний премії Адамса за твір про рух вихорів
- У 1897 відкрив електрон, за що в 1906 році був удостоєний Нобелівської премії з фізики з формулюванням «за дослідження проходження електрики через гази».
- Був нагороджений медалями Б. Франкліна (1923 р), М. Фарадея (1938 г.), Коплі (1914) та ін.

Починає методичне кількісне вивчення відхилення катодних променів в електричних і магнітних полях. У своєму досвіді Томсон довів, що всі частинки, що утворюють катодні промені, тотожні один одному і входять до складу речовини.
Суть дослідів полягає у висуванні гіпотези про існування матерії в стані ще більш тонкого дроблення, ніж атом.
Ті частинки, які входили до складу катодних променів, були незабаром названі електронами.
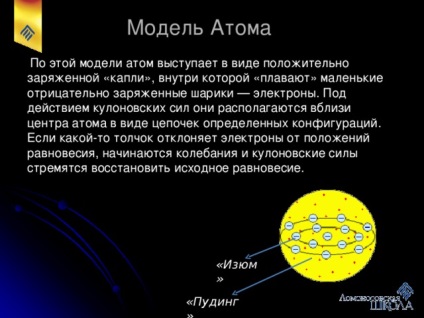
За цією моделлю атом виступає у вигляді позитивно зарядженої «краплі», всередині якої «плавають» маленькі негативно заряджені кульки - електрони. Під дією кулонівських сил вони розташовуються поблизу центру атома у вигляді ланцюжків певних конфігурацій. Якщо якийсь поштовх відхиляє електрони від положень рівноваги, починаються коливання і кулонівських сили прагнуть відновити оригінал рівновагу.

Основні ідеї Томсона
- Про шарах електронів в атомі
- Про втрату електронів атомами
- Про стійкість атома

«Я не можу пригадати іншого вченого-сучасника Резерфорда, в лабораторії якого виховувалося б стільки великих фізиків»

за будовою атомів
