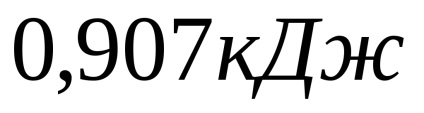Лабораторна робота 3. Тепловий ефект реакції нейтралізації
Мета роботи. Освоїти методику калориметричних вимірів; визначити тепловий ефект реакції нейтралізації сірчаної кислоти лугом; опанувати термохімічними розрахунками.
Хімічний процес. Сірчану кислоту можна нейтралізувати двома способами. Перший спосіб - це послідовна нейтралізація в дві стадії.
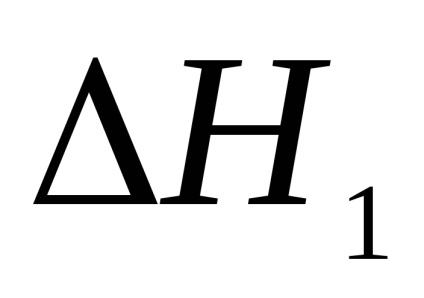
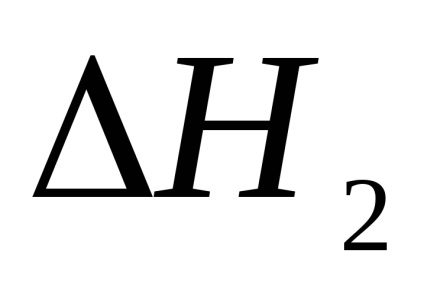
Другий спосіб - повна нейтралізація сірчаної кислоти в одну стадію.
При цьому необхідно враховувати, що сірчана кислота є слабкою кислотою по другого ступеня дисоціації з Кдіс = 1,2 · 10 -2.
Експериментальна частина. Визначення теплового ефекту реакції виробляла приладом, званим калориметром. Найпростіший з них зображений на малюнку 2.
Досвід 1. Нейтралізація сірчаної кислоти в дві стадії.
В
Досвід 2. Нейтралізація сірчаної кислоти в одну стадію.
У калориметрический стакан налив 50 см 3 1М розчину сірчаної кислоти. Виміряв температуру (t1). У циліндр налив 50 см 3 2М розчину лугу NaOH. У розчин кислоти швидко і без втрат вилив з циліндра луг. Перемішав шляхом струшування отриманий розчин середньої солі Na2 SO4. Виміряв максимальну температуру (t2). Результати досвіду заніс в таблицю 1.
досвід I (1,2) досвід II (3)
Обробка результатів досвіду
Теплота, що виділяється в результаті реакції нейтралізації, обчислюється за формулою
,

де
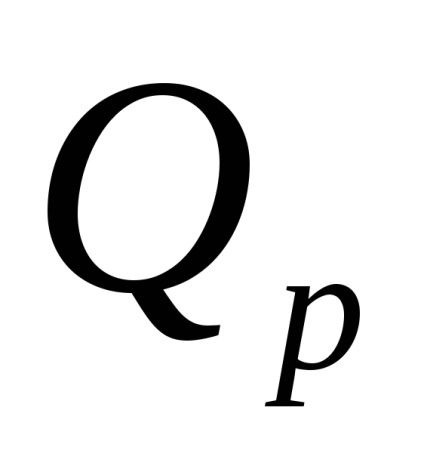




10 -3 - перевідний коефіцієнт Дж в кДж.
Введення ефективної питомої теплоємності розчину пов'язано з тим, що тепловий ефект реакції нейтралізації витрачається не тільки на нагрівання самого розчину, але і нагріванні стінок внутрішньої частини колориметра (скляного стакана), причому маса цієї частини системи строго кажучи невідома, на нагрівання термометра, на випаровування води при зростанні температури розчину і т.д. Через відносно малі обсяги кислоти і підстави вплив цих факторів значно, і для обліку цього впливу вводять так звану «постійну калориметр», яка в нашій випадку замінена ефективної теплоємністю розчинів.
1. Розрахував парниковий ефект першої і другої стадії реакції нейтралізації в першому досвіді.
2. Розрахував тепловий ефект реакції нейтралізації у другому досвіді.
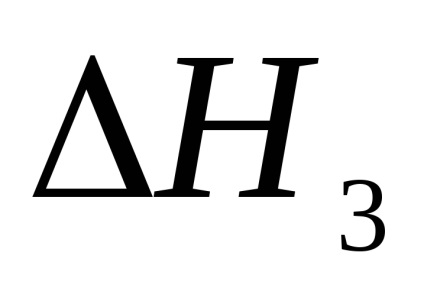
3. На підставі слідства із закону Гесса розрахував теоретичний тепловий ефект реакції нейтралізації сірчаної кислоти лугом, при відомих теплотах освіти продуктів реакції і вихідних речовин, які дані в таблиці 2.


Внаслідок того, що різниця теплових ефектів в обох дослідах незначна, можна зробити висновок, що слідство закону Гесса виконується.
Висновок: В ході виконання лабораторної роботи, я освоїв методику калориметричних вимірів, опанував термохімічними розрахунками, визначив тепловий ефект реакції нейтралізації сірчаної кислоти лугом двома способами. Тепловий ефект в першому досвіді дорівнював; у другому досвіді -; теоретичний тепловий ефект вийшов рівним 31.82кДж. Підтвердив виконання слідства закону Гесса. Відносна похибка в першому досвіді дорівнює 2,85%, у другому - 7,41%; абсолютна похибка в першому досвіді дорівнює -