Амінокислоти - структурні компоненти белков.Белкі, або протеїни (грец. Protos - першорядний), - це біологічні гетерополімери, мономерами яких є амінокислоти.
Амінокислоти являють собою низькомолекулярні органічні сполуки, що містять карбоксильну (-СООН) і амінну (-NH2) групи, які пов'язані з одним і тим же атомом вуглецю. До атому вуглецю приєднується бічний ланцюг - будь-якої радикал, що надає кожній амінокислоті певні властивості. Загальна формула амінокислот має вигляд:
У більшій частині амінокислот є одна карбоксильна група і одна аміногрупа; ці амінокислоти називаються нейтральними. Існують, однак, і основні амінокислоти - з більш ніж однієї аминогруппой, а також кислі амінокислоти - з більш ніж однієї карбоксильної групою.
Відомо близько 200 амінокислот, що зустрічаються в живих організмах, проте тільки 20 з них входять до складу білків. Це так звані основні, або белокобразующіе (Протеїногенні), амінокислоти.
Залежно від виду радикала основні амінокислоти ділять на три групи: 1) неполярні (аланін, метіонін, валін, про-лін, лейцин, ізолейцин, триптофан, фенілаланін); 2) полярні незаряджені (аспарагін, глутамін, серії, гліцин, тирозин, треонін, цистеїн); 3) полярні заряджені (аргінін, гістидин, лізин - позитивно; аспарагінова і глутамінова кислоти - негативно).
Бічні ланцюга амінокислот (радикал) можуть бути гідрофобними або гідрофільними, що надає білків відповідні властивості, які проявляються при утворенні вторинної, третинної і четвертинної структур білка.
У рослин всі необхідні амінокислоти синтезуються з первинних продуктів фотосинтезу. Людина і тварини не здатні синтезувати ряд протеіногенних амінокислот і повинні отримувати їх в готовому вигляді разом з їжею. Такі амінокислоти називаються незамінними. До них відносяться лізин, валін, лейцин, ізолейцин, треонін, фенілаланін, триптофан, метіонін; атакож аргінін і гістидин - незамінні для дітей,
У розчині амінокислоти можуть виступати в ролі як кислот, так і основ, т. Е. Вони є амфотерними сполуками. Карбоксильная група -СООН здатна віддавати протон, функціонуючи як кислота, а аминная - NH2 - приймати протон, виявляючи таким чином властивості підстави.
Пептиди. Аміногрупа однієї амінокислоти здатна вступати в реакцію з карбоксильної групою іншої амінокислоти.
Утворюється при цьому молекула являє собою дипептид, а зв'язок -CO-NH- називається пептидного зв'язком:
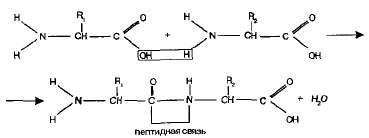
На одному кінці молекули дипептиду знаходиться вільна аміногрупа, а на іншому - вільна карбоксильна група. Завдяки цьому дипептид може приєднувати до себе інші амінокислоти, утворюючи олігопептиди. Якщо таким чином з'єднується багато амінокислот (більше десяти), то виходить поліпептид.
Пептиди грають важливу роль в організмі. Багато олиго- і поліпептиди є гормонами, антибіотиками, токсинами.
До олігопептиди відносяться окситоцин, вазопресин, тиреотропин, а також брадикінін (пептид болю) і деякі опіати ( «природні наркотики» людини), що виконують функцію знеболювання. Ухвалення наркотиків руйнує опіатних систему організму, тому наркоман без дози наркотиків відчуває сильний біль - «ломку», яка в нормі знімається опіатами. До олігопептиди відносяться і деякі антибіотики (наприклад, граміцидин S).
Багато гормони (інсулін, адренокортикотропний гормон та ін,), антибіотики (наприклад, граміцидин А), токсини (наприклад, дифтерійний токсин) є поліпептидами.
Білки являють собою поліпептиди, в молекулу яких входить від п'ятдесяти до декількох тисяч амінокислот з відносною молекулярною масою понад 10 000.
Структура білків. Кожному білку в певному середовищі властива особлива просторова структура. При характеристиці просторової (тривимірної) структури виділяють чотири рівні організації молекул білків (рис. 1,1).
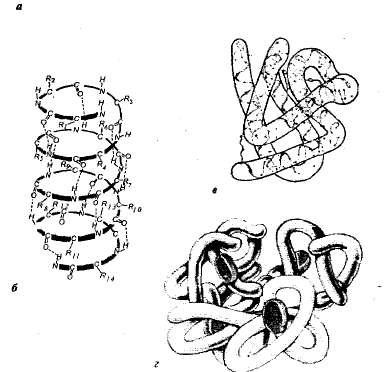
Мал. 1.1. Рівні структурної організації білка: а - первинна структура - амінокислотна послідовність белкарібонуклеази (124 амінокислотних ланки); б - вторинна структура - пояіпептідная ланцюг закручена у вигляді спіралі; в - третинна структура білка міоглобіну; г - четвертинна структура гемоглобіну.
Первинна структура - послідовність амінокислот у поліпептидному ланцюзі. Така структура специфічна для кожного білка і визначається генетичною інформацією, т. Е. Залежить від послідовності нуклеотидів в ділянці молекули ДНК, що кодує даний білок. Від первинної структури залежать усі властивості та функції білків. Заміна однієї-єдиної амінокислоти в складі молекул білка або порушення порядку в їх розташуванні зазвичай тягне за собою зміну функції білка.
З огляду на, що до складу білків входить 20 видів амінокислот, число варіантів їх комбінацій в поліпептидного ланцюга воістину безмежно, що забезпечує величезну кількість видів білків в живих клітинах. Наприклад, в організмі людини виявлено понад 10 тис. Різних білків, і всі вони побудовані з одних і тих же 20 основних амінокислот.
У живих клітинах молекули білків або окремі їх ділянки являють собою не витягнуту ланцюг, а скручені в спіраль, що нагадує розтягнуту пружину (це так звана а-спіраль), або складені в складчастий шар (р-шар). Такі а-спіралі і р-шари є вторинною структурою. Вона виникає в результаті утворення водневих зв'язків всередині однієї поліпептидного ланцюга (спіральна конфігурація) або між двома поліпептидними ланцюгами (складчасті шари).
Повністю a-спіральну конфігурацію має білок кератин. Це структурний білок волосся, нігтів, кігтів, дзьоба, пір'я і рогів; він входить до складу зовнішнього шару шкіри хребетних.
У більшості білків спіральні і неспіральние ділянки поліпептидного ланцюга складаються в тривимірне утворення кулястої форми - глобулу (характерна для глобулярних білків). Глобула певної конфігурації є третинної структурою білка. Така структура стабілізується іонними, водневими, ковалентними дисульфідними зв'язками (утворюються між атомами сірки, що входять до складу цистит-на, цистину і мегіоніна), а також гідрофобними взаємодіями. Найбільш важливими у виникненні третинної структури є гідрофобні взаємодії; білок при цьому згортається таким чином, що його гідрофобні бічні ланцюги приховані усередині молекули, т. е. захищати від контакту з водою, а гідрофільні бічні ланцюги, навпаки, виставлені назовні.
Багато білки з особливо складною будовою складаються з декількох поліпептидних ланцюгів (субодиниць), утворюючи четвертинних структуру білкової молекули. Така структура є, наприклад, у глобулярного білка гемоглобіну. Його молекула складається з чотирьох окремих поліпептидних субодиниць (протомеров), що знаходяться в третинної структурі, і небілкової частини - гема.
Тільки в такій структурі гемоглобін здатний виконувати свою транспортну функцію.
Під впливом різних хімічних та фізичних факторів (обробка спиртом, ацетоном, кислотами, лугами, високою температурою, опроміненням, високим тиском і т. Д.) Відбувається зміна вторинної, третинної і четвертинної структур білка внаслідок розриву водневих і іонних зв'язків. Процес порушення нативної (природною) структури білка називається денатурацією. При цьому спостерігається зменшення розчинності білка, зміна форми і розмірів молекул, втрата ферментативної активності і т. Д. Процес денатурації може бути повним або частковим. У деяких випадках перехід до нормальних умов середовища супроводжується мимовільним відновленням природної структури білка. Такий процес називається ренатурацією.
Прості і складні білки. За хімічним складом виділяють білки прості і складні. До простьм відносяться білки, що складаються тільки з амінокислот, а до складний - білки, що містять білкову частину і небілкової (простетичної); простетичної групу можуть утворювати іони металів, залишок фосфорної кислоти, вуглеводи, ліпіди та ін. Простими білками є сироватковий альбумін крові, фібрин, деякі ферменти (трипсин) і ін. До складних білок відносяться всі протеоліпіди і глікопротеїни; складними білками є, наприклад, імуноглобуліни (антитіла), гемоглобін, більшість ферментів і т. д.
Структурна. Білки входять до складу клітинних мембран і матриксу органел клітини. Стінки кровоносних судин, хрящі, сухожилля, волосся, нігті, кігті у вищих тварин складаються переважно з білків.
Каталітична (ферментативна). Білки-ферменти каталізують протікання всіх хімічних реакцій в організмі. Вони забезпечують розщеплення поживних речовин в травному тракті, фіксацію вуглецю при фотосинтезі і т. Д.
Транспортна. Деякі білки здатні приєднувати і переносити різні речовини. Альбуміни крові транспортують жирні кислоти, глобуліни - іони металів і гормони, гемоглобін - кисень і вуглекислий газ. Молекули білків, що входять до складу плазматичної мембрани, беруть участь в транспортуванні речовин в клітку.
Захисна. Її виконують імуноглобуліни (антитіла) крові, що забезпечують імунний захист організму. Фібриноген і тромбін беруть участь в згортанні крові і запобігають кровотеча.
Скорочувальна. Завдяки ковзанню відносно один одного Актинові і міозінових протофібрілл відбувається скорочення м'язів, а також нем'язові внутрішньоклітинні скорочення. Рух війок і джгутиків пов'язано з ковзанням щодо один одного мікротрубочок, що мають білкову природу.
Регуляторна. Багато гормонів є олігопептиди або бедки (наприклад, інсулін, глюкагон [антагоніст інсуліну], адренокортикотропний гормон та ін.).
Рецепторная. Деякі білки, вбудовані в клітинну мембрану, здатні змінювати свою структуру під впливом зовнішнього середовища. Так відбувається прийом сигналів ззовні і передача інформації в клітку. Прикладом може служити фіто-хром - світлочутливий білок, який регулює фотоперіодичну реакцію рослин, і опсин - складова частина родопсину, пігменту, що знаходиться в клітинах сітківки ока.
Енергетична. Білки можуть служити джерелом енергії в клітині (після їх гідролізу). Зазвичай білки витрачаються на енергетичні потреби в крайніх випадках, коли вичерпані запаси вуглеводів і жирів.
Ферменти (ензими). Це специфічні білки, які присутні у всіх живих організмах і відіграють роль біологічних каталізаторів.
Хімічні реакції в живій клітині протікають при певній температурі, нормальному тиску і відповідної кислотності середовища. В таких умовах реакції синтезу або розпаду речовин протікали б в клітці дуже повільно, якби вони не піддавалися впливам ферментів. Ферменти прискорюють реакцію без зміни її загального результату за рахунок зниження енергії активації, тобто. Е. При їх присутності потрібно значно менше енергії для додання реакційної здатності молекул, які вступають в реакцію, або реакція йде іншим шляхом з меншим енергетичним бар'єром.
Всі процеси в живому організмі прямо або побічно здійснюються за участю ферментів. Наприклад, під їх дією складові компоненти їжі (білки, вуглеводи, ліпіди та ін.) Розщеплюються до більш простих сполук, а з них вже потім синтезуються нові, властиві даному виду макромолекули. Тому порушення освіти і активності ферментів нерідко ведуть до виникнення важких хвороб.
За просторової організації ферменти складаються з декількох підлогу і пептидних ланцюгів і зазвичай мають четвертинної структурою. Крім того, ферменти можуть включати і небілкові структури. Білкова частина носить назву апофермент, а небілкова - кофактор (якщо це катіони чи аніони неорганічних речовин, наприклад, Zn2- Мп2 + і т. Д.) Або кофермент (коензим) (якщо це низькомолекулярні органічна речовина).
Попередниками або складовими частинами Багатьох кофер-ментів є вітаміни. Так, пантотенова кислота - складова частина коензиму А, нікотинова кислота (вітамін РР) - попередник НАД та НАДФ і т. Д.
Ферментативний каталіз підкоряється тим же законам, що і неферментативного каталіз в хімічній промисловості, проте на відміну від нього характеризується надзвичайно високим ступенем специфічності (фермент каталізує тільки одну реакцію або діє тільки на один тип зв'язку). Цим забезпечується тонка регуляція всіх життєво важливих процесів (дихання, травлення, фотосинтез і ін.), Що протікають в клітині і організмі. Наприклад, фермент уреаза каталізує розщеплення лише одного речовини - сечовини (H2N-CO-NH2 + Н2 О -> - »2NH 3 + СО2), не надаючи каталітичної дії на структурно-родинні з'єднання.
Для розуміння механізму дії ферментів, що володіють високою специфічністю, дуже важлива теорія активного центру. Відповідно до неї, в молекулі кожного ферменту є одні ділянку або більш, в яких відбувається каталіз за рахунок тісної (у багатьох точках) контакту між молекулами ферменту і специфічної речовини (субстрату). Активним центром виступає або функціональна група (наприклад, ОН-група серину), або окрема амінокислота. Зазвичай же для каталітичного дії необхідне поєднання декількох (в середньому від 3 до 12) розташованих в певному порядку амінокислотних залишків. Активний центр також формується пов'язаними з ферментом іонами металів, вітамінами та іншими сполуками небілкової природи - коферментами, або кофакторами. Причому форма і хімічну будову активного центру такі, що з ним можуть зв'язуватися тільки певні субстрати в силу їх ідеального відповідності (взаємодоповнюваності або. Комплементарності) один одному. Роль інших амінокислотних залишків у великій молекулі ферменту полягає в тому, щоб забезпечити його молекулі відповідну глобулярную форму, яка потрібна для ефективної роботи активного центру. Крім того, навколо великої молекули ферменту виникає сильне електричне поле. В такому полі стає можливою орієнтація молекул субстрату і придбання ними асиметричної форми. Це призводить до ослаблення хімічних зв'язків, і каталізується реакція відбувається з меншою початковій витратою енергії, а отже, з набагато більшою швидкістю. Наприклад, одна молекула ферменту каталази може розщепити за 1 хв більше 5 млн. Молекул пероксиду водню (Н202), який виникає при окисленні в організмі різних з'єднань.
У деяких ферментів в присутності субстрату конфігурація активного центру зазнає змін, т. Е. Фермент орієнтує свої функціональні групи таким чином, щоб забезпечити найбільшу каталітичну активність.
На заключному етапі хімічної реакції фермент-субстратної комплекс відокремлюється з утворенням кінцевих продуктів і вільного ферменту. Звільнився при цьому активний центр може приймати нові молекули субстрату.
Швидкість ферментативних реакцій залежить від багатьох факторів: природи і концентрації ферменту і субстрату, температури, тиску, кислотності середовища, наявності інгібіторів і т. Д. Наприклад, при температурах, близьких до нуля, швидкість біохімічних реакцій сповільнюється до мінімуму. Це властивість широко використовується в різних галузях народного господарства, особ-но в сільському господарстві та медицині. Зокрема, консервація різних органів (нирок, серця, селезінки, печінки) перед їх пересадкою хворому відбувається при охолодженні з метою зниження інтенсивності біохімічних реакцій і продовження часу життя органів. Швидке заморожування харчових продуктів запобігає ріст і розмноження мікроорганізмів (бактерій, грибів та ін.), Атакож інактивує їх травні ферменти, так що вони виявляються вже не в змозі викликати розкладання харчових продуктів.
Список літератури
Н.А. Лемеза Л.В.Камлюк Н.Д. Лисов "Посібник з біології для вступників до ВНЗ"