гідролізі неправильних аміноаціладенілатов. За рахунок існування в активному центрі цих ферментів коригуючого механізму, що забезпечує негайне видалення помилково приєднаного амінокислотного залишку, досягається разюче висока точність роботи: на 1300 пов'язаних з тРНК амінокислот зустрічається тільки одна помилка.
Амінокислота, приєднуючись до тРНК, надалі не визначає специфічних властивостей аа-тРНК, так як її структуру не впізнає ні рибосома, ні мРНК. Участь в синтезі білка залежить тільки від структури тРНК, а точніше, від комплиментарного взаємодії антикодону аміноацил-тРНК з кодоном мРНК.
Антикодон розташований в центральній (антикодоновой) петлі тРНК. Впізнавання тРНК аа-тРНК синтетазами не завжди відбувається по антикодоновой петлі. Активний центр деяких ферментів виявляє комплементарне відповідність іншим ділянкам просторової структури тРНК.
Рибосоми представляють собою рібонуклеопротеіновие освіти - своєрідні «фабрики», на яких йде складання амінокислот в білки. Еукаріотичні рибосоми мають константу седиментації 80S і складаються з 40S (малої) і 60S (великий) субодиниць. Кожна субодиниця включає рРНК і білки. В 40S субодиницю входить рРНК з константою седиментації 18S і близько 30-40 білків. В 60S субодиниці виявлено 3 види рРНК: 5S, 5,8S і 28S і близько 50 різних білків.
Білки входять до складу субодиниць рибосоми в кількості однієї копії і виконують структурну функцію, забезпечуючи взаємодію між мРНК і тРНК, пов'язаними з амінокислотою або пептидом.
У присутності мРНК 40S і 60S субодиниць об'єднуються з утворенням повної рибосоми, маса якої приблизно в 650 разів більше маси молекули гемоглобіну.
У рибосомі є 2 центри для приєднань молекул тРНК: аміноацільний (А) і пептідільний (Р) центри, в освіті яким беруть участь обидві субодиниці. Разом центри А і Р включають ділянку мРНК, рівний 2 кодонам. Під час трансляції центр А пов'язуємо аа-тРНК, будова якої визначає кодон, що знаходиться в області цього центру. У Струк турі цього кодону зашифрована природа амінокислоти, яка буде включена в зростаючу поліпептидний ланцюг. Центр Р займає пептидил-тРНК, тобто тРНК, пов'язана з пептидного ланцюжком, яка вже синтезована.
У еукаріотів розрізняють рибосоми 2 типом «вільні», які виявляються в цитоплазма клітин, і пов'язані з ендоплазматичним ретикулумом (ЕР). Рибосоми, асоціювання з ЕР, відповідальні за синтез білків «на експорт», які виходять в плазму крові і беруть участь в оновленні білків ЕР; мембрани aаппарата Гольджі, мітохондрій або лізосом.
Мітохондрії містять свій набір рибосом. Мітохондріальні рибосоми дрібніше, ніж рибосоми еукаріотів, прокаріотів і мають константу седиментації 55S. Вони також складаючись з двох субодиниць, але відрізняються від еукаріріотіческіх рибосом кількістю і складом РНК і білків.
білкові фактори
У кожній стадії білкового синтезу на рибосомі: ініціації, елонгації та термінації бере участь різний набір внерібосомних білковий чинників. Ці білки зв'язуються з рибосомою або її субодиницями на певних стадіях процесу і стабілізують або полегшують функціонування белоксинтезирующей машини.
АТФ і ГТФ як джерела енергії
На включення однієї амінокислоти в зростаючу поліпептидний ланцюг клітина витрачає 4 макроергічні зв'язку: 2 з АТФ в ході реакції, що каталізується аа-тРНК синтетазой (в процесі активації амінокислот АТФ розщеплюється на АМФ і пірофосфат), і 2 молекули ГТФ: одна використовується на зв'язування АА- тРНК в а-центрі рибосоми, а друга витрачається на стадію транслокації. До цього | слід додати використання ще двох макроергічних зв'язків молекул: АТФ і ГТФ на ініціацію і терминацию синтезу поліпептидного ланцюга.
Етапи синтезу поліпептидного ланцюга
Синтез білка є циклічний багатоступінчастий енергозалежний процес, в якому вільні амінокислоти полімеризується в генетично детерміновану послідовність з утворенням поліпептидів. Система білкового синтезу, точніше система трансляції, яка використовує генетичну інформацію, транскрибований в мРНК, для синтезу поліпептидного ланцюга з певною первинної структурою, включає близько 200 типів макромолекул - білків і нуклеїнових кислот. Серед них близько 100 макромолекул, що беруть участь в активації амінокислот і їх перенесенні на рибосоми, більше 60 макромолекул, що входять до складу 70S або 80S рибосом, і близько 10S макромолекул, які беруть безпосередню участь в системі трансляції. Чи не розбираючи природу інших важливих для синтезу факторів, розглянемо детально механізм індивідуальних шляхів синтезу білкової молекули в штучній синтезує системі. Перш за все за допомогою ізотопного методу було з'ясовано, що синтез білка починається з N-кінця і завершується C-кінцем, тобто процес протікає в напрямку. NH2®COOH.
Білковий синтез, або процес трансляції, може бути умовно розділений на 2 етапи: активування амінокислот і власне процес трансляції.
Другий етап матричного синтезу білка, власне трансляцію, що протікає в рибосомі, умовно ділять на три стадії: ініціації, елонгації та термінації.
активація амінокислот
Необхідною умовою синтезу білка, який в кінцевому рахунку зводиться до полімеризації амінокислот, є наявністю в системі не вільних, а так званих активованих амінокислот, які мають своїм внутрішнім запасом енергії. Активація вільних аміноксилот здійснюється за допомогою специфічних ферментів аміноацил -тРНК-синтетаз в присутності АТФ. Цей процес протікає в 2 стадії:
Обидві стадії катализируются одним і тим же ферментом. На першій стадії амінокислота реагує з АТФ і утворюється пірофосфат і проміжний продукт, який на другій стадії реагує з відповідною 3 ¢ -ОН-тРНК, в результаті чого утворюється аміноацил -тРНК і звільняється АМФ. Аминоацил-тРНК розпорядженні необхідний запас енергії.
Амінокислота приєднується до кінцевого 3 ¢ -ОН-гідроксилу АМФ, який разом з двома залишками ЦМФ утворює кінцевий триплет ЦЦА, що є однаковим для всіх транспортних РНК.
процеси трансляції
Ініціація трансляції є подія, в ході якого відбувається образованиe комплексу, що включає Мет-тРНКiмет, мРНК і рибосому, десь тРНКiмет ініціює метіонінових тРНКВ цьому процесі беруть участь не менше 10 факторів ініціації, які позначають як elF (від англ. Eukaryotic initiation factors) з зазначенням номера та літери. Спочатку 40S субодиниця рибосоми з'єднується з фактором ініціації, який перешкоджає її зв'язування з 60S субодиницею, але стимулює об'єднання з потрійним комплексом, що включає Мет-тРНКiмет, eIF-2 і ГТФ. Потім цей тепер вже більш складний комплекс зв'язується з 5'-кінцем мРНК за участю декількох elF. Один з факторів ініціації (elF-4F) дізнається і приєднується до ділянки «кеп» на молекулі мРНК, тому він отримав назву кепсвязивающего білка. Прикрепившись до мРНК, 40S субодиниця починає ковзати по некодирующей частини мРНК до тих пір, поки не досягне ініціюючого кодону AUG кодує нуклеотидної послідовності. Ковзання 40S субодиниці по мРНК супроводжується гідролізом АТФ, енергія якого витрачається на подолання ділянок спирализации в нетрансльовані частини мРНК. В еукаріотичних Клек некодуючі ділянки мРНК мають різну довжину, але зазвичай від 40 до 80 нуклеотидів, хоча зустрічаються області з завдовжки понад 700 нуклеотидів.
Досягнувши початку кодує мРНК, 40S субодиниця зупиняється і зв'язується з іншими факторами ініціації, які прискорюють приєднання 60S субодиниці і освіту 80S рибосоми за рахунок гідролізу ГТФ до ГДФ і неорганічного фосфату. При цьому формуються А- і Р-центри рибосоми, причому в Р-центрі виявляється AUG-кодон мРНК з приєднаним до нього Мет-тРНКiмет.
У клітинах є 2 розрізняються по структурі тРНК, які дізналися кодон AUG. Ініціює кодон довідається тРНКiмет, а триплети мРНК, що кодують включення метіоніну у внутрішні ділянки білка, прочитуються інший тРНКiмет
По завершенні ініціації рибосома розташовується на мРНК таким чином, що в Р-центрі знаходиться ініціює кодон AUG з приєднаною до нього Мет-тРНКiмет. а в А-центрі - триплет, який кодує включення першої амінокислоти синтезованого білка. Далі починається найтриваліший етап білкового синтезу - елонгація, в ході якого рибосома за допомогою аа-тРНК послідовно «читає» мРНК у вигляді триплетів нуклеотидів, наступних за який ініціює кодоном в напрямку від 5 'до -кінцю, нарощуючи полипептидную ланцюжок за рахунок послідовного приєднання амінокислот.
Включення кожної амінокислоти в білок відбувається в 3 стадії, в ході яких:
• аа-тРНК кожної що входить в білок амінокислоти зв'язується з А-центром рибосоми;
• пептид від пептидил-тРНК, що знаходиться в Р-центрі, приєднується до a-NH2-группe аміноацільного залишку аа-тРНК А-центра з утворенням нової пептидного зв'язку;
• подовжена на один амінокислотний залишок пептидил-тРНК переміщується з А-центру в Р-центр в результаті транслокації рибосоми.
Зв'язування аміноацил-тРНК в А-центрі. Кодон мРНК, що розташовується в А-центрі поруч з ініціював кодоном, визначаємо природу аа ¢ -тРНКаа ¢, яка буде включена в А-центр. аа ¢ -тРНКаа ¢ взаємодіє з рибосомою в вигляді потрійного комплексу, що складається з фактора елонгації EF-1, аа ¢ -тРНКаа ¢, і ГТФ Комплекс ефективно взаємодіє з рибосомою лише в тому випадку, якщо антикодон аа ¢ -тРНКаа ¢, компліментарен і антирівнобіжний кодону мРНК в А-центрі. Включення аа ¢ -тРНКаа ¢, в рибосому відбувається за рахунок енергії гідролізу ГТФ до ГДФ і неорганічного фосфату
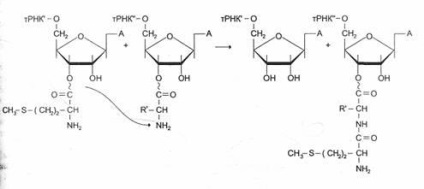
Освіта пептидного зв'язку відбувається відразу ж після відщеплення комплексу EF-1 і ГДФ від рибосоми. Ця стадія процесу отримала назву реакції транспептідаціі.
В ході цієї реакції залишок метіоніну аа ¢ -тРНКаа ¢, зв'язується з a-аміногрупи першої амінокислоти, приєднаної до Трнка ¢, і pacположенной в А-центрі, утворюється перша пептидний зв'язок. Встановлено, що пептіділтранс | феразная активність великої субодиниці рибосоми належить 28S рРНК. До теперішнього часу виявлена ціла група РНК, що володіє властивостями ферментів. Ці каталитически активні РНК отримали назву рибозимов Вважають, що рибозими можна вважати «реліктами» раннього періоду революції, коли білки ще не придбали такого значення, як в наступні періоди.
Транслокация - третя стадія елонгації. До рибосоми приєднується фактор елонгації EF-2 і за рахунок енергії ГТФ просуває рибосому по мРНК на один кодон до -кінцю. В результаті дипептидил-тРНК, яка не змінює свого положення щодо мРНК, з А-центру переміщається в Р-центр. Вільна від метіоніну Трнка ¢, залишає рибосому, а в область А-центра потрапляє наступний кодон.
По завершенні третьої стадії елонгації рибосома в Р-центрі має дипептидил-тРНК, а в А-центр потрапляє триплет, який кодує включення в поліпептидний ланцюг другий амінокислоти. Починається наступний цикл стадії елонгації, в ході якого на рибосомі знову проходять вищеописані події. Повторення таких циклів за кількістю смислових кодонів мРНК завершує весь етап елонгації.
Терминация трансляції настає в тому випадку, коли в А-центр рибосоми потрапляє один з стоп-кодонів: UAG, UAA або UGA. Для стоп-кодонів немає відповідних тРНК. Замість цього до рибосоми приєднуються 2 білкових вивільняє фактора RF (від англ, releasing / actor) або фактора термінації. Один з них за допомогою пептидилтрансферазного центру каталізує гидролитическое відщеплення синтезованого пептиду від тРНК. Інший за рахунок енергії гідролізу ГТФ викликає дисоціацію рибосоми на субодиниці.
Цікаво відзначити, що чинники трансляції, реалізують ефекти за рахунок гідролізу ГТФ, є членами суперсімейства G-білків, в яке входять G-білки, що беруть участь в трансдукції сигналів гормонів та інших біологічно активних речовин, і Ras-білки, що функціонують як фактори росту. Все G-білки пов'язують і гидролизуют ГТФ. Коли вони пов'язані з ГТФ, то активні і беруть участь у відповідних метаболічних процесах, а коли в активному центрі в результаті гідролізу ГТФ перетворюється в ГДФ, ці білки набувають неактивну конформацію.
Таким чином, матрична природа процесу трансляції проявляється в тому, що послідовність надходження аміноацил-тРНК рибосому для синтезу білка суворо детермінована мРНК, тобто порядок розташування кодонів вздовж ланцюга мРНК однозначно задає структуру синтезованого білка. Рибосома сканує ланцюг мРНК у вигляді триплетів і послідовно відбирає з навколишнього середовища «потрібні» аа-тРНК, звільняючи в ході елонгації деацильованої тРНК.
Мала і велика субодиниці рибосоми: процесі трансляції виконують різні функції: мала субодиниця приєднує мРНК декодує інформацію за допомогою тРНК механізму транслокації, а велика суб'еданіца відповідальна за утворення пептидних зв'язків.
полірібосоми
У процесі синтезу білка рибосома приєднується до 5'-кінця мРНК і переміщається в напрямку -кінця. При цьому 5'-кінець мРНК звільняється, і до нього може приєднатися нова рибосома, на якій починається poст ще однієї поліпептидного ланцюга. Як правило багато рибосом одночасно бере участь в синтезі білка на одній і тій же мРНК, утворюючи комплекс, який називають полірібосомамі, або полисомой.
Кожна рибосома займає на мРНК ділянку довжиною близько 80 нуклеотидів, тому рібрсоми розташовуються на мРНК з інтервалом приблизно в 100 нуклеотидів. Чим довше полипептидная ланцюжок синтезованого білка, тим більше рибосом може одночасно здійснювати синтез цього білка, значно збільшує таким чином ефективність використання матриці.
Кожна рибосома здатна каталізувати утворення близько 100 пептидних зв'язків в хвилину. Полірібосоми можуть існувати у вигляді частинок, плаваючих в цитоплазмі клітин, або можуть бути пов'язані з ЕР. Вільні цитоплазматические полірібосомние частки відповідальні за синтез білків, що виконують внутрішньоклітинні функції. Полірібосоми, асоційовані з ЕР, під електронним мікроскопом мають вигляд «шорсткою» поверхні. Білки, синтезовані «шорстким» ЕР, повинні транспортуватися через мембрану для того, щоб вони досягли місця остаточної локалізації. Для них характерна присутність на N-кінці лидерной, або сигнальної, послідовності довжиною від 15 до 30 амінокислотних залишків, яка містить багато амінокислот з гідрофобними радикалами і забезпечує проходження білка через ліпідний бішар мембран. Деякі з цих білків для подальшого транспорту упаковуються апаратом Гольджі в секреторні гранули.
Транспорт синтезованих білків через мембрани.
Синтез мітохондріальних білків
В мітохондріях клітин вищих організмів міститься до 2% клітинної ДНК, що відрізняється від ДНК ядра. Мітохондрії містять весь апарат, включаючи рибосоми, тРНК і МРН К, необхідний для синтезу певних білків. Синтезовані в мітохондріях білки в основному відносяться до нерозчинним білкам, які беруть участь в організації структури цих органел, в той час як джерелом синтезу розчинних мітохондріальних білків є рибосоми цитоплазми, звідки вони потім транспортуються в мітохондрії. Рибосоми в мітохондріях мають менший розмір ніж 80S рибосоми в цитоплазмі. Цікаво відзначити, що в якості ініціює амінокислоти при синтезі білка в мітохондріях еукаріот може брати участь N-формілметіонін, а не вільний метіонін, як в цитоплазмі. Ця обставина свідчить про те, що мітохондріальний синтез білка за своїм механізмом, очевидно, близький до синтезу білка у прокаріот.
Посттрансляційні модифікації поліпептидного ланцюга
Поліпептидні ланцюги можуть піддаватися структурним модифікаціям, або будучи ще пов'язаними з рибосомами, або після завершення синтезу. Ці конформаційні і структурні зміни поліпептидних ланцюгів отримали назву посттрансляційних змін. Вони включають видалення частини поліпептидного ланцюга, ковалентное приєднання одного або кількох низькомолекулярних лігандів, придбання білком нативної конформації.
Багато модифікації здійснюються в ЕР. Тут відбуваються фолдінг поліпептидних ланцюгів і формування унікальної третинної або четвертинної структури білків. Причому для підтримки нативної конформації молекул величезне значення має правильне формування дисульфідних зв'язків.
частковий протеоліз
Багато білки, секретуються з клітин, спочатку синтезуються у вигляді молекул-попередників, функціонально неактивних. Видалення частини поліпептидного ланцюга специфічними ендопротеаз призводить до утворення активних молекул. Деякі білки-попередники розщеплюються в ЕР або апараті; Гольджі. інші - після секреції. Так, неактивні попередники секретується ферментів - зімогени - утворюють активний фермент після розщеплення по певних ділянок молекули: зимоген панкреатичної залози трипсиноген перетворюється в активний трипсин після секреції