Щонайменшої часткою речовини є молекула, що утворюється в результаті взаємодії атомів, між якими діють хімічні зв'язки або хімічний зв'язок. Вчення про хімічний зв'язок складає основу теоретичної хімії. Хімічна зв'язок виникає при взаємодії двох (іноді більше) атомів. Освіта зв'язку відбувається з виділенням енергії.
Хімічна зв'язок - це взаємодія, яке пов'язує окремі атоми в молекули, іони, кристали.
Хімічна зв'язок за своєю природою єдина: вона має електростатичне походження. Але в різноманітних хімічних сполуках хімічний зв'язок буває різного типу; найбільш важливі типи хімічного зв'язку - це ковалентний (неполярні, полярна), іонна, металева. Різновидами цих типів зв'язку є донорно-акцепторні, воднева і ін. Між атомами металів виникає металева зв'язок.
Хімічна зв'язок, здійснювана за рахунок утворення спільної, або поділеної, пари або декількох пар електронів, називається ковалентним. В освіту однієї загальної пари електронів кожен атом вносить по одному електрону, тобто бере участь «в рівній частці» (Льюїс, 1916 г.). Нижче наведені схеми освіти хімічних зв'язків в молекулах H2, F2, NH3 і CH4. Електрони, що належать різним атомам, позначені різними символами.
В результаті утворення хімічних зв'язків кожен з атомів в молекулі має стійку дво- і восьміелектронную конфігурацію.
При виникненні ковалентного зв'язку відбувається перекривання електронних хмар атомів з утворенням молекулярного електронної хмари, що супроводжується виграшем енергії. Молекулярне електронне хмара розташовується між центрами обох ядер і має підвищену електронної щільністю в порівнянні з щільністю атомного електронної хмари.
Здійснення ковалентного зв'язку можливо лише в разі антипаралельних спінів неспарених електронів, що належать різним атомам. При паралельних спинах електронів атоми не притягають, а відштовхуються: ковалентний зв'язок не здійснюється. Метод опису хімічного зв'язку, утворення якої пов'язано із загальною електронної парою, називається методом валентних зв'язків (МВС).
Основні положення МВС
Ковалентний хімічний зв'язок утворюється двома електронами з протилежно спрямованими спинами, причому ця електронна пара належить двом атомам.
Ковалентний зв'язок тим міцніше, чим більшою мірою перекриваються взаємодіючі електронні хмари.
При написанні структурних формул електронні пари, що зумовлюють зв'язок, часто зображуються рисками (замість точок, що зображують усуспільнені електрони).
Важливе значення має енергетична характеристика хімічного зв'язку. При утворенні хімічного зв'язку загальна енергія системи (молекули) менше енергії складових частин (атомів), тобто ЕAB<ЕА+ЕB.
Валентність - це властивість атома хімічного елемента приєднувати або заміщувати певне число атомів іншого елемента. З цієї точки зору валентність атома найпростіше визначати по числу атомів водню, що утворюють з ним хімічні зв'язки, або числом атомів водню, що заміщуються атомом цього елемента.
З розвитком квантовомеханических уявлень про атом валентність стали визначати числом неспарених електронів, що беруть участь в утворенні хімічних зв'язків. Крім неспарених електронів, валентність атома також залежить від числа порожніх і повністю заповнених орбіталей валентного електронного шару.
Енергія зв'язку - це енергія, яка виділяється при утворенні молекули з атомів. Енергію зв'язку зазвичай висловлюють в кДж / моль (або ккал / моль). Це одна з найважливіших характеристик хімічного зв'язку. Більш стійка та система, яка містить менше енергії. Відомо, наприклад, що атоми водню прагнуть об'єднатися в молекулу. Це означає, що система, що складається з молекул Н2 містить менше енергії, ніж система, що складається з такого ж числа атомів Н, але не об'єднаних в молекули.
Мал. 2.1 Залежність потенційної енергії Е системи з двох атомів водню від меж'ядерного відстані r: 1 - при утворенні хімічного зв'язку; 2 - без її утворення.
На малюнку 2.1 показана енергетична крива, характерна для взаємодіючих атомів водню. Зближення атомів супроводжується виділенням енергії, яке буде тим більше, чим більше перекриються електронні хмари. Однак у звичайних умовах, внаслідок кулонівського відштовхування, неможливо досягти злиття ядер двох атомів. Значить, на якомусь відстані замість тяжіння атомів, відбуватиметься їх відштовхування. Таким чином, відстань між атомами r0, якому відповідає мінімум на енергетичній кривій, буде відповідати довжині хімічного зв'язку (крива 1). Якщо ж спини електронів у взаємодіючих атомів водню однакові, то буде відбуватися їх відштовхування (крива 2). Енергія зв'язку для різних атомів змінюється в межах 170-420 кДж / моль (40-100 ккал / моль).
Процес переходу електрона на більш високий енергетичний підрівень або рівень (тобто процес збудження або розпарювання, про який говорилося раніше) вимагає витрати енергії. При утворенні хімічного зв'язку відбувається виділення енергії. Для того, щоб хімічний зв'язок була стійкою, необхідно, щоб збільшення енергії атома за рахунок порушення було менше енергії утворюється хімічний зв'язок. Іншими словами, необхідно, щоб витрати енергії на збудження атомів були компенсовані виділенням енергії за рахунок утворення зв'язку.
Хімічна зв'язок, крім енергії зв'язку, характеризується довжиною, кратністю і полярністю. Для молекули, що складається більш ніж з двох атомів, істотними є величини кутів між зв'язками і полярність молекули в цілому.
Кратність зв'язку визначається кількістю електронних пар, що зв'язують два атома. Так, в етан Н3С-СН3 зв'язок між атомами вуглецю одинарна, в етилену Н2С = СН2 - подвійна, в ацетилені НСºСН - потрійна. Зі збільшенням кратності зв'язку збільшується енергія зв'язку: енергія зв'язку С-С становить 339 кДж / моль, С = С - 611 кДж / моль і CºC - 833 кДж / моль.
Хімічна зв'язок між атомами зумовлюється перекриванням електронних хмар. Якщо перекривання відбувається уздовж лінії, що з'єднує ядра атомів, то такий зв'язок називається сигма-зв'язком (# 963;-зв'язок). Вона може бути утворена за рахунок двох s-електронів, s- і p-електронів, двох px-електронів, s і d електронів (наприклад):
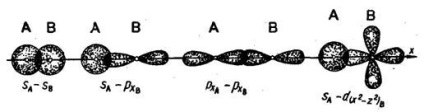
Хімічна зв'язок, здійснювана однією електронною парою, називається одинарної. Одинарна зв'язок - завжди # 963;-зв'язок. Орбіталі типу s можуть утворювати лише # 963;-зв'язку.
Зв'язок двох атомів може здійснюватися більш ніж однією парою електронів. Такий зв'язок називається кратною. Прикладом освіти кратному зв'язку може служити молекула азоту. У молекулі азоту px-орбіталі утворюють одну # 963;-зв'язок. При утворенні зв'язку pz -орбіталямі виникають дві області
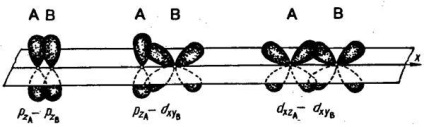
Такий зв'язок називається пі-зв'язком (π-зв'язок). Виникнення π-зв'язку між двома атомами відбувається тільки тоді, коли вони вже пов'язані # 963; -зв'язком. Другу π-зв'язок в молекулі азоту утворюють ру-орбіталі атомів. При утворенні π-зв'язків електронні хмари перекриваються менше, ніж в разі # 963; -зв'язків. Внаслідок цього π-зв'язку, як правило, менш міцні, ніж # 963;-зв'язку, утворені тими ж атомними орбиталями.
р-орбіталі можуть утворювати як # 963; -, так і π-зв'язку; в кратних зв'язках одна з них обов'язково є # 963; -зв'язком:.
Таким чином, в молекулі азоту з трьох зв'язків одна - # 963;-зв'язок і дві - π-зв'язку.
Довжиною зв'язку називається відстань між ядрами пов'язаних атомів. Довжини зв'язків в різних з'єднаннях мають величини десятих часток нанометра. При збільшенні кратності довжини зв'язків зменшуються: довжини зв'язків N-N. N = N і NºN рівні 0,145; 0,125 і 0,109 нм (10-9 м), а довжини зв'язків C-C, C = C і CºC рівні, відповідно, 0,154; 0,134 і 0,120 нм.
Між різними атомами чиста ковалентний зв'язок може проявлятися, якщо електроотріцаельность (ЕО) 1 атомів однакова. Такі молекули електросімметрічни, тобто «Центри тяжіння» позитивних зарядів ядер і негативних зарядів електронів збігаються в одній точці, тому їх називають неполярними.
Якщо з'єднуються атоми володіють різною ЕО, то електронне хмара, що знаходиться між ними, зміщується з симетричного положення ближче до атома з більшою ЕО:
Зсув електронної хмари називається поляризацією. В результаті односторонньої поляризації центри ваги позитивних і негативних зарядів в молекулі не збігаються в одній точці, між ними виникає деяку відстань (l). Такі молекули називаються полярними або диполями, а зв'язок між атомами в них називається полярною.
Полярна зв'язок - різновид ковалентного зв'язку, зазнала незначну односторонню поляризацію. Відстань між «центрами тяжіння» позитивних і негативних зарядів в молекулі називається довжиною диполя. Природно, що чим більше поляризація, тим більше довжина диполя і більше полярність молекул. Для оцінки полярності молекул зазвичай користуються постійним дипольним моментом (Мр), що представляє собою твір величини елементарного електричного заряду (e) на довжину диполя (l), тобто .
Дипольні моменти вимірюють в Деба Д (Д = 10-18 ел. Ст. Од. × см, тому що елементарний заряд дорівнює 4,810-10 ел. Ст. Од. А довжина диполя в середньому дорівнює відстані між двома ядрами атомів, т . Е. 10-8 см) або кулонометр (Кл × м) (1 Д = 3,33 # 903; 10-30 Кл × м) (заряд електрона 1,6 # 903; 10-19 Кл помножений на відстань між зарядами , наприклад, 0,1 нм, тоді Мр = 1,6 # 903; 10-19 × 1 × 10-10 = 1,6 # 903; 10-29 Кл # 903; м). Постійні дипольні моменти молекул мають значення від нуля до 10 Д.
У неполярних молекул l = 0 і Мр = 0, тобто вони не мають дипольним моментом. У полярних молекул Мр> 0 і досягає значень 3,5 - 4,0 Д.
При дуже великій різниці ЕО у атомів має місце явна одностороння поляризація: електронне хмара зв'язку максимально зміщується в бік атома з найбільшою ЕО, атоми переходять в протилежно заряджені іони і виникає іонна молекула:
Ковалентний зв'язок стає іонної. Електроасімметрія молекул зростає, довжина диполя збільшується, дипольний момент зростає до 10 Д.
Сумарний дипольний момент складної молекули можна вважати рівним векторній сумі дипольних моментів окремих зв'язків. Дипольний момент зазвичай прийнято вважати спрямованим від позитивного кінця диполя до негативного.
Передбачити полярність зв'язку можна за допомогою відносної ЕО атомів. Чим більше різниця відносних ЕО атомів, тим сильніше виражена полярність: DЕО = 0 - неполярная ковалентний зв'язок; DЕО = 0 - 2 - полярна ковалентний зв'язок; DЕО = 2 - іонна зв'язок. Правильніше говорити про ступінь ионности зв'язку, оскільки зв'язку не бувають іонними на 100%. Навіть в з'єднанні CsF зв'язок іонна тільки на 89%.
Хімічна зв'язок, що виникає за рахунок переходу електронів від атома до атома, називається іонної, а відповідні молекули хімічних сполук - іонними. Для іонних з'єднань в твердому стані характерна іонна кристалічна решітка. У розплавленому і розчиненому стані вони проводять електричний струм, мають високу температуру плавлення і кипіння і значним дипольним моментом.
Якщо розглядати з'єднання елементів будь-якого періоду з одним і тим же елементом, то в міру пересування від початку до кінця періоду переважно іонний характер зв'язку змінюється на ковалентний. Наприклад, у фторидів 2-го періоду LiF, BeF2, CF4, NF3, OF2, F2 ступінь ионности зв'язку від фториду літію поступово слабшає і замінюється типово ковалентним зв'язком в молекулі фтору.
Таким чином, природа хімічного зв'язку єдина: принципової різниці в механізмі виникнення ковалентного полярної і іонної зв'язків немає. Ці види зв'язку відрізняються лише ступенем поляризації електронного хмари молекули. Виникаючі молекули відрізняються довжинами диполів і величинами постійних дипольних моментів. У хімії значення дипольного моменту дуже велике. Як правило, чим більше дипольний момент, тим вище реакційна здатність молекул.
Механізми утворення хімічного зв'язку
У методі валентних зв'язків розрізняють обмінний і донорно-акцепторні механізми утворення хімічного зв'язку.
Обмінний механізм. До обмінним механізмом утворення хімічного зв'язку відносяться випадки, коли в освіті електронної пари від кожного атома бере участь по одному електрону.
У молекулах Н2, Li2, Na2 зв'язку утворюються за рахунок неспарених s-електронів атомів. У молекулах F2 і Cl2 - за рахунок неспарених р-електронів. У молекулах HF і HCl зв'язку утворюються s-електронами водню і p-електронами галогенів.
Особливістю утворення сполук за обмінним механізмом є насичуваності, яка показує, що атом утворює не будь-яке, а обмежена кількість зв'язків. Їх число, зокрема, залежить від кількості неспарених валентних електронів.
З квантових осередків N і Н можна бачити, що атом азоту має 3
неспарених електрона, а атом водню - один. Принцип насичуваності вказує на те, що стійким з'єднанням повинен бути NH3, а не NH2, NH або NH4. Однак існують молекули, що містять непарне число електронів, наприклад, NO, NO2, ClO2. Всі вони характеризуються підвищеною реакційною здатністю.
На окремих стадіях хімічних реакцій можуть утворюватися і валентно ненасичені групи, які називаються радикалами, наприклад, H, NH2, O, CH3. Реакційна здатність радикалів дуже висока і тому час їх існування, як правило, мало.
Донорно-акцепторні механізм
Відомо, що валентно насичені сполуки аміак NH3 і трифторид бору BF3 реагують один з одним по реакції
NH3 + BF3 = NH3BF3 + 171,4 кДж / моль.
Розглянемо механізм цієї реакції:
Видно, що з чотирьох орбіталей бору три заселені, а одна - залишається вакантною. У молекулі аміаку заселені всі чотири орбіталі азоту, з них три - за обмінним механізмом електронами азоту і водню, а одна містить електронну пару, обидва електрона якої належать азоту. Така електронна пара називається неподіленої електронної парою. Освіта з'єднання H3N # 903; BF3 відбувається за рахунок того, що неподіленого електронних пари аміаку займає вакантну орбіталь фториду бору. При цьому зменшується потенційна енергія системи і виділяється еквівалентну кількість енергії. Подібний механізм утворення називають донорно-акцепторні, донором - такий атом, який віддає свою електронну пару для утворення зв'язку (в даному випадку атом азоту); а атом, який надаючи вакантну орбіталь, приймає електронну пару, називається акцептором (в даному випадку атом бору). Донорно-акцепторная зв'язок є різновидом ковалентного зв'язку.
У поєднанні H3N # 903; BF3 азот і бор - чотирьохвалентного. Атом азоту підвищує свою валентність від 3 до 4 в результаті використання неподіленої електронної пари для освіти додаткової хімічного зв'язку. Атом бору підвищує валентність за рахунок наявності у нього вільної орбіталі на валентном електронному рівні. Таким чином, валентність елементів визначається не тільки числом неспарених електронів, а й наявністю неподіленого електронних пар і вільних орбіталей на валентном електронному рівні.
Більш простим випадком утворення хімічного зв'язку по