Різновиди хімічного зв'язку
Зовнішні оболонки всіх елементів, крім благородних газів, є незавершеною і в процесі хімічної взаємодії вони ЗАВЕРШУЮТЬСЯ.
Хімічна зв'язок утворюється за рахунок електронів зовнішніх електронних оболонок, але здійснюється вона по-різному.
Розрізняють три основних типи хімічного зв'язку:
- ковалентний зв'язок і її різновиди: полярну і неполярну ковалентний зв'язок;
Іонна хімічний зв'язок - це зв'язок, що утворилася за рахунок електростатичного притягання катіонів до анионам.
Іонна зв'язок виникає між атомами, що різко відрізняються один від одного величинами електронегативності, тому пара електронів, що утворює зв'язок, сильно зміщена до одного з атомів, так що можна вважати її належить атому цього елемента.
Електронегативність - це здатність атомів хімічних елементів притягувати до себе свої і чужі електрони.
Природу іонної зв'язку, структуру і властивості іонних з'єднань пояснюють з позиції електростатичної теорії хімічних зв'язків.
Наприклад: 2Na 0 + Cl2 0 = 2Na + Cl -
При горінні металевого натрію в хлорі в результаті окислювально-відновлювальних реакції утворюються катіони сильно електропозитивного елемента натрію і аніони сильно-електронегативного елемента хлору.
Висновок: іонна хімічний зв'язок утворюється між атомами металу і неметалла, сильно відрізняються по електронегативності.
Ковалентним зв'язком називається зв'язування атомів за допомогою загальних (поділених між ними) електронних пар.
Розглянемо виникнення ковалентного неполярной зв'язку на прикладі утворення молекули водню з двох атомів водню. Цей процес вже є типовою хімічною реакцією, тому що з одного речовини (атомарного водню) утворюється інше - молекулярний водень. Зовнішнім ознакою енергетичної "вигідності" цього процесу є виділення великої кількості теплоти.
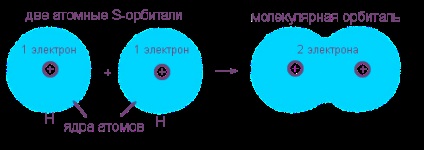
Електронні оболонки атомів водню (з одним s-електроном у кожного атома) зливаються в загальний електронну хмару (молекулярну орбіталь), де обидва електрона "обслуговують" ядра незалежно від того, "своє" це ядро або "чуже". Нова електронна оболонка подібна завершеною електронній оболонці інертного газу гелію з двох електронів: 1s 2.
На практиці використовують більш прості способи. Наприклад, американський хімік Дж. Льюїс в 1916 році запропонував позначати електрони
поруч з символами елементів. Одна точка позначає один електрон. У цьому випадку утворення молекули водню з атомів записується так:
Розглянемо зв'язування двох атомів хлору 17 Cl (заряд ядра Z = 17) в двоатомних молекул з позицій будови електронних оболонок хлору.
На зовнішньому електронному рівні хлору міститься s 2 + p 5 = 7 електронів. Оскільки електрони нижніх рівнів не беруть участі в хімічній взаємодії, точками позначимо тільки електрони
третього рівня. Ці зовнішні електрони (7 штук) можна розташувати у вигляді трьох електронних пар і одного неспареного електрона.
Після об'єднання в молекулу з неспарених електронів двох атомів виходить нова електронна пара:
При цьому кожен з атомів хлору виявляється в оточенні
електронів. У цьому легко переконатися, якщо обвести кружком будь-який з атомів хлору.
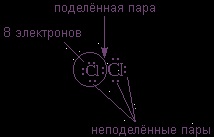
Ковалентний зв'язок утворює тільки пара електронів, що знаходиться між атомами. Вона називається
Решта пар електронів називають
Вони заповнюють оболонки і не беруть участь в зв'язуванні.
Атоми утворюють хімічні зв'язки в результаті усуспільнення такої кількості електронів, щоб придбати електронну конфігурацію, подібну завершеною електронної конфігурації атомів благородних елементів.
За теорією Льюїса і правилом октету зв'язок між атомами може здійснюватися не обов'язково однієї, а й
поділеними парами, якщо цього вимагає правило октету. Такі зв'язки називаються
подвійними і потрійними.
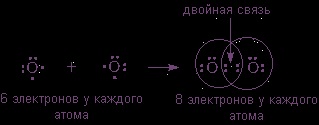
може утворювати двоатомних молекул з октетом електронів у кожного атома тільки тоді, коли між атомами поміщаються дві поділені пари:
(2s 2 2p 3 на останній оболонці) також зв'язуються в двоатомних молекул, але для організації октету електронів їм потрібно розташувати між собою вже три поділені пари:
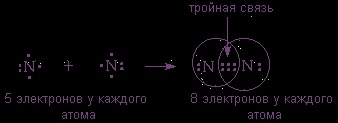
Висновок: ковалентний неполярний зв'язок виникає між атомами з однаковою електронегативністю, т. Е. Між атомами одного хімічного елемента - неметалла.
Наприклад: в молекулах H2 Cl2 N2 P4 Br2 - ковалентний неполярний зв'язок.
Полярна ковалентний зв'язок
займає проміжне положення між чисто ковалентного зв'язком і іонним зв'язком. Так само, як і іонна, вона може виникнути тільки між двома атомами різних видів.
Як приклад розглянемо освіту води в реакції між атомами водню (Z = 1) і кисню (Z = 8). Для цього зручно спочатку записати електронні формули для зовнішніх оболонок водню (1s 1) і кисню (. 2s 2 2p 4).
Виявляється, для цього необхідно взяти саме два атома водню на один атом кисню. Однак природа така, що акцепторні властивості атома кисню вище, ніж у атома водню (про причини цього - трохи пізніше). Тому що зв'язують електронні пари в формулі Льюїса для води злегка зміщені до ядру атома кисню. Зв'язок в молекулі води - полярна ковалентний, а на атомах з'являються часткові позитивні і негативні заряди.
Висновок: ковалентний полярна зв'язок виникає між атомами з різною електронегативність, т. Е. Між атомами різних хімічних елементів - неметалів.
- ковалентная полярна зв'язок.
В даний час прийнято зображати електронні пари (тобто хімічні зв'язки) між атомами
Кожна рисочка - це поділена пара електронів. У цьому випадку вже знайомі нам молекули виглядають так:
Формули з рисками між атомами називаються структурними формулами.
Найчастіше в структурних формулах не зображують неподіленого пари електронів
Структурні формули дуже гарні для зображення молекул: вони чітко показують - як атоми пов'язані між собою, в якому порядку, якими зв'язками.
Зв'язує пара електронів в формулах Льюїса - те ж саме, що одна риска в структурних формулах.
Подвійні і потрійні зв'язки мають загальну назву -
Про молекулі азоту також говорять, що вона має
дорівнює трьом. У молекулі кисню порядок зв'язку дорівнює двом. Порядок зв'язку в молекулах водню і хлору - один. У водню і хлору вже не кратна, а проста зв'язок.
Порядок зв'язку - це число обобществленних поділених пар між двома пов'язаними атомами. Порядок зв'язку вище трьох не зустрічається.