Спирти - сполуки, що містять одну або кілька гідроксильних груп ОН, пов'язаних з вуглеводневим радикалом.
Залежно від числа гідроксильних груп спирти ділять на одно- (CH3 OH - метанол, 2 H5 OH - етанол), дво- (CH2 (OH) -CH2 -OH - етиленгліколь) і трьохатомні (CH2 (OH) -CH (OH) -CH2 -OH - гліцерин). Залежно від того, при якому вуглецевому атомі знаходиться гідроксильна група, розрізняють первинні (R-CH2 -OH), вторинні (R2 CH-OH) і третинні спирти (R3 C-OH). У назві спиртів присутній суфікс - ол.
одноатомні спирти
Загальна формула гомологічного ряду граничних одноатомних спиртів Cn H2n + 1 OH.
Для граничних одноатомних спиртів характерна ізомерія вуглецевого скелета (починаючи з бутанола), а також ізомерія положення гідроксильної групи (починаючи з пропанола) і межклассовая ізомерія з простими ефірами.
Фізичні властивості
Нижчі спирти (до С15) - рідини, вищі - тверді речовини. Метанол і етанол змішуються з водою в будь-яких співвідношеннях. З ростом молекулярної маси розчинність спиртів у оді падає. Спирти мають високі температури кипіння і плавлення за рахунок утворення водневих зв'язків.
отримання спиртів
Отримання спиртів можливо за допомогою біотехнологічного (бродіння) способу з деревини або цукру.
До лабораторних методів отримання спиртів відносяться:
- гідратація алкенів (реакція протікає при нагріванні і в присутності концентрованої сірчаної кислоти)
- гідроліз алкилгалогенидов під дією водних розчинів лугів
СН3 Br + NaOH → CH3 OH + NaBr
- відновлення карбонільних сполук
Хімічні властивості
1. Реакція, що протікають з розривом зв'язку О-Н:
- кислотні властивості спиртів виражені дуже слабо. Спирти реагують з лужними металами
але не реагують з лугами. У присутності води алкоголяти повністю гідролізуються:
Це означає, що спирти - більш слабкі кислоти, ніж вода
- утворення складних ефірів під дією мінеральних і органічних кислот:
- окислення спиртів під дією дихромата або перманганату калію до карбонільних сполук. Первинні спирти окислюються в альдегіди, які, в свою чергу, можуть окислюватися в карбонові кислоти.
R-CH2 -OH + [O] → R-CH = O + [O] → R-COOH
Вторинні спирти окислюються в кетони:
R-CH (OH) -R '+ [O] → R-C (R') = O
Третинні спирти більш стійкі до окислення.
2. Реакція з розривом зв'язку С-О.
- внутримолекулярная дегідратація з утворенням алкенів (відбувається при сильному нагріванні спиртів з водовіднімаючих речовинами (концентрована сірчана кислота)):
- межмолекулярная дегідратація спиртів з утворенням простих ефірів (відбувається при слабкому нагріванні спиртів з водовіднімаючих речовинами (концентрована сірчана кислота)):
- слабкі основні властивості спиртів проявляються в оборотних реакціях з галогеноводородами:
Приклади розв'язання задач
Визначте молярну масу і будова спирту, якщо відомо, що при взаємодії 7,4 г цього спирту з металевим натрієм виділяється 1,12 л газу (н.у.), а при окисленні оксидом міді (II) утворюється з'єднання, яке дає реакцію « срібного дзеркала ».
Складемо рівняння реакцій спирту ROH з: а) натрієм; б) окислювачем CuO:
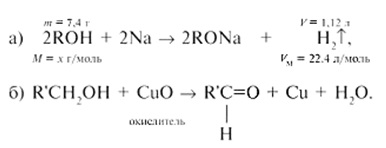
З рівняння (а) методом відносин визначимо молярну масу невідомого спирту:
Таку молярну масу мають спирти С4 Н10 О. Причому згідно з умовою завдання [рівняння (б)] це можуть бути первинні спирти - бутанол-1 СН3 СН2 СН2 СН2 ОН або 2-метілпропанол-1 (СН 3) 2 СНСН2 ОН.
М (С4 Н10 О) = 74 г / моль, це бутанол-1 або 2-метілпропанол-1