Продуктами переробки літієвих концентратів є солі літію (карбонат, сульфат, хлорид) і гідроксид. Най-більш поширений кінцевий продукт - карбонат літію, який служить вихідним матеріалом для отримання інших сполук, зокрема хлориду літію, з якого вироб-водять металевий літій.
У промисловій практиці переважно застосовують три способи розкладання літієвих концентратів: сірчанокислотний, сульфатний (спікання з K2S04) і вапняний. Крім того, іноді використовують вапняно-хлоридні спосіб.
Розкладання сірчаною кислотою використовують для літієвих концентратів всіх типів: сподуменовиє, лепідолітових і амблігонітових. В результаті розкладання концентрату кон-центрованої сірчаної кислотою при 200 - 250 ° С і після-дме вилуговування продукту водою отримують розчини, які містять сульфат літію, з яких беруть в облогу карбонат літію.
Переробка сподумена. Для ефективного розкладання сподумена сірчаною кислотою необхідна первинна тер-мическая обробка його приблизно при 1100 ° С для перетворений-ня а - в / 3-сподумен (а - сподумен практично не розкладаючись-ється сірчаною кислотою.). Випал проводять в барабанної печі. Особливість взаємодії сірчаної кислоти з / 3- сподуменом полягає в заміщенні катіонів літію протонами кислоти при збереженні структури / 3-сподумена:
Li20 • А1203 • 4Si02 + H2S04 Li2S04 + Н20 *
* А1203 • 4Si02. (10.1)
Оскільки кремній і алюміній залишаються в незмінною ре-щітка алюмосилікат, літій вибірково витягується в водний розчин, який тому містить порівняно ма-ло домішок.
Концентрат і сірчану кислоту змішують в шнеку, який подає суміш в барабанну піч (сталевий нефутерованний барабан), де при 250 ° С швидко (10 - 15 хв) протікає сульфатізація.
Сульфатізірованний матеріал витравлюють водою, пода-вая в реактор крейда для нейтралізації надлишку сірчаної кисло-ти (до рН = 6 + 6,5). Відфільтрований розчин очищають від магнію нейтралізацією вапном (рН = 12 + 14), а потім від кальцію осадженням Сас03 содою.
Домішки заліза і алюмінію осаджують у формі гідроксидів при рН = 7 при одночасній випаровуванню розчину до кон-рації Li2S04 200 г / л.
Після відділення осаду фільтрацією з розчину обложена-ють карбонат літію насиченим розчином соди. Промиті опади містять 96 - 97% Li2C03. Витяг в карбонат з сподуменовиє концентрату складає 85 - 90%.
Переробка лепідоліту. Лепідоліт можна безпосередній-но сульфатізіровать сірчаною кислотою при 320 - 330 ° С. Для прискорення процесу іноді застосовують попереднє пла-тичних лепідоліту при 1090 ° С, перетворюючи його в стеклооб-різну масу, яку після подрібнення сульфатізірующий.
Отримувані при переробці лепідоліту сірчанокислий рас-творити містять Li2S04, K2S04, Na2S04, Al2 (S04) 3.
Більшу частину алюмінію зазвичай виділяють в формі каліе-вих квасцов K [A1 (S04) 2] • 12Н20, охолоджуючи розчини до -5
0 ° С (в розчин додають сульфат калію). Додатково алюміній виділяють з нейтралізованого розчину в складі А1 (ОН) 3. В процесі подальшого випарювання розчину кристалізується частина K2S04 і Na2S04. З відфільтрованого розчину осаджують карбонат літію.
Спосіб заснований на спіканні літієвих концентратів з сульфатом калію з подальшим вилуговуванням спека водою.
У разі переробки сподумена в процесі спікання, проведеного при 920 - 1150 ° С, а-сподумен перетворюється в / 3-сподумен, який вступає в обмінну реакцію з сульфа-те калію:
2 (Li, Na) [Al (Si03) 2] + K2S04 2 (K, Na) [Al (Si03) 2] + U2S04. (Ю-2)
При охолодженні а-лейцит переходить в / 3-лейцит. Перехід а * # 9632; / 3-сподумен сприяє швидкому протіканню твер-дофазной реакції внаслідок того, що при перебудові ре-шеткі атоми мають підвищеною рухливістю.
Так як реакція (10.2) оборотна, потрібен великий через биток K2S04
На рис. 80 приведена типова схема переробки Господа-мена сульфатним способом.
Шихту спекают в барабанних печах при 1100 - 1150 ° С протягом 1 - 2 год. Вилуговування проводять на холоду в барабанних млинах (розчинність Li2S04 знижується з підвищеними-ням температури).
Сульфатні Щолоков містять 110 - 150 г / л Li2S04, 150 -
200 г / л K2S04, значні кількості Na2S04 домішки
Змішання і подрібнення Cnenatfue
(Конверсія в K2SO4 і пі в відвал)
(На приготування воствора Na2C03j
Ріс.80. Технологічна схема переробки сподумена спеканием з сульфатом калію
Сульфатів Mg, Al, Fe. Ці домішки осаджують в формі гідро - Ксідо гідроксидом натрію або карбонатом калію. Подальше-щую переробку розчинів з виділенням карбонату літію проводять, використовуючи різні варіанти. Один з них поки-зан на рис. 80. У цьому варіанті основна кількість суль-фата калію виділяють кристалізацією подвійної солі 3K2S04 - Na2S04 (глазеріта), яку використовують для приготування шихти сподумена з K2S04.
Сульфатний спосіб застосовують також для переробки ле-підоліта і ціннвальдіта, відмінність лише в дозуванні суль-фата калію в шихті і нижче температура спікання (850 - - 950 ° С).
До переваг сульфатного способу переробки літіе-вого сировини відносяться його універсальність і висока сте-пень розтину концентрату. Недолік - висока витрата сульфату калію. Однак створення більш раціональних схем переробки розчинів, що забезпечують високий ступінь ре-генерації K2S04, дозволить істотно поліпшити економі-етичні показники процесу.
Вапняний спосіб полягає в спіканні літієвих концентратів (сподумена або лепідоліту) з вапном або крейдою. При подальшому вилуговуванні спека водою отримують розчин, що містить гідроксид літію, який кристалізується-ється в результаті випаровування розчину в складі моногід-рата LiOH • Н20.
Розглянемо основи цього процесу на прикладі сподумена. При спіканні сподумена з вапном (або крейдою) в барабан-них печах при 1150 - 1200 ° С утворюється алюмінат літію і силікат кальцію:
Li20 • А1203 • 4Si02 + 8СаО =
= Li20 • А1203 + 4 (2СаО • Si02). (10.3)
При вилуговуванні спека водою в присутності надлишку вапна алюмінат літію реагує з Са (ОН) 2 з утворенням гідроксиду літію:
Li20 • АІ2Оетв) + Са (ОН) 2 (розчин) = 2ЬІОН (розчин) + СаО • А12Оетв). (Ю.4)
Вміщені в спікся алюмінати калію і натрію також реагують з Са (ОН) 2, утворюючи КОН і NaOH. Гідроксид літію LiOH • HjO кристалізують з розчинів шляхом випарювання під вакуумом. Випаровування проводять в декілька стадій. З розчинів з концентрацією LiOH
160 г / л після охолодження виділяються кристали LiOH • Н20, які відокремлюють від ма-точного розчину центрифугуванням. Матковий розчин повертається на випарювання. У міру накопичення домішок маткові розчини періодично виводять з циклу і направ-ляють на регенерацію.
Якщо необхідно, кристали LiOH • Н20 очищають пере-кристалізацією, використовуючи для розчинення очищену по-ду. Для отримання безводного гідроксиду літію моногідрат зневоднюють при 600 - 650 ° С.
Вапняний спосіб застосовують також при переробці ле - підолітових концентратів. На відміну від сподумена спікання лепідоліту з вапном (або крейдою) проводять при більш низ-кою температурі (900 - 950 ° С).
До переваг вапняного способу відносяться його застосовність до будь-яких типів літієвих концентратів, можливість прямого отримання гідроксиду літію, дешевизна реа-Гент, можливість використання відходів (шлаків, содер-службовців силікати і алюмінати кальцію) для виробництва вяза-жущіх будівельних матеріалів, а також можливість попуті-ного отримання солей калію з маткових розчинів.
Разом з тим, спосіб має серйозні недоліки. Він переважно вживають щодо багатим літієвим концентратів, однак і в цьому випадку витяг в готовий продукт не перевищує 70%, що обумовлено обмеженою растворімос-ма гідроксиду літію і здатністю шламів після вищела-чування до схоплювання. Інший недолік - необхідність випарювання великих обсягів розчинів.
Отримання чистого хлориду літію
0,1; Si02 0,05; POf 0,005. 336
Для отримання хлориду літію зазначеної чистоти зазвичай потрібна попередня очистка карбонату літію від при-домішок. Очищення проводять методом перекристалізації через добре розчинний бікарбонат літію (спосіб Труст). З цією метою через водну суспензію Li2C03 пропускають С02, що призводить до переходу літію в розчин у вигляді бікарбона-та LiHC03.
При кип'ятінні розчину бікарбонат руйнується, з р. ас - твора осідає очищений Li2C03.
Для отримання хлориду літію вологий карбонат розчин-ють в 30% -ної соляної кислоти. Розчин очищають від домішки іонів SOJ "додаванням ВаС12. Потім для очищення від інших домішок розчин нейтралізують додаванням LiOH до щелоч-ності 0,01 н. При кип'ятінні виділяються гідроксиди, карбо-нати або основні солі домішок кальцію, барію, магнію, заліза.
Очищений розчин з концентрацією LiCl 350 - 360 г / л надходить на випарювання. Труднощі випарювання і після-дме зневоднення хлориду зумовлені високою Корекція дірующей здатністю LiCl і його розчинів. Для випарівая-ня використовують апарати з кераміки або спеціальних спла-вів, а для зневоднення хлориду - керамічну апарату-ру. В результаті випаровування кристалізується хлорид LiCl • Н20. Хлорид потім зневоднюють при 120 - 150 ° С.
3. ТЕХНОЛОГІЯ ВИРОБНИЦТВА ЛІТІЮ
Отримання літію електролізом
Внаслідок високого спорідненості до кисню і до галогенів літій отримують або електролізом розплавлених середовищ, або металотермічним відновленням з відгонкою літію.
Електроліз проводять в електроліті при співвідношенні LiCl: КС1 = 1: 1 (за масою), що близько до складу ев-тектікі в системі LiCl - КС1, плавиться при 361 ° С. Це дозволяє проводити електроліз при 400 - 460 ° С.
На рис. 81 показана принципова схема електролізера з двома прікатодном просторами, відокремленими від анод-ного простору діафрагмами. Сталевий кожух ванни фут-ють графітом - найбільш стійким матеріалом по отноше-нию до хлориду літію. Однак і графіт повільно взаємодією-
Ріс.81. Схема електролізера для отримання металевого літію: 1 - графітовий футерування; 2 - діафрагма з залізної сеткк; 3 - сталеві катоди; 4 - рідкий чи-тий; 5 - бункер для завантаження з-лей; 6 - отвір для вичерпуючи-ня рідкого літію; 7 - діафрагма; 8 - графітоіий анод; 9 - сталевий кожух ванни; 10 - камера для ра-зогрева ванни; 11 - газова го-Релком
Твует з утворенням карбіду літію Li2C2, що розкладається в електроліті з виділенням вуглецю. Графитовая футерування і аноди в промислових ваннах працюють близько трьох міся-ців. Для отримання літію більш високої чистоти застосовують металеві злектолізери з водоохолоджуваними стінками, на яких утворюється гарніссаж з застиглих солей, защи-щающую електроліт від взаємодії з металевою стінкою.
Для розплавлення електроліту можна використовувати зовн-ний нагрів, в подальшому тепловий режим підтримується теплом, що виділяється при проходженні струму через елект-Роліт.
Катодами служать пластини з низьковуглецевої сталі, анодами - графітові стрижні. Потенціали розкладання LiCl і КС1 в електроліті евтектичного складу при 400 ° С рівні 3,78 і 3,89 В відповідно, що обумовлює часткове виділення калію на катоді.
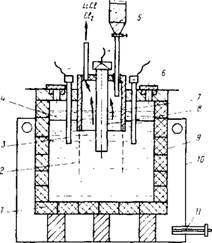
Електроліз ведуть при 400 - 430 ° С при щільності струму на катоді і аноді 2,0 - 5,0 і 0,8 - 1,5 А / см2 відпо-венно. Вихід по току досягає 90 - 93%. Вирізняється на катоді рідкий літій спливає на поверхню електроліту, і його вичерпують залізної сітчастої ложкою в міру накопи-лення. Метал захищений від окислення тонкою плівкою солей, добре змочують рідкий літій.
Хлор з анодного простору спрямовується в абсорбер, зрошувану вапняним молоком.
Електролізом, крім літію, можна отримувати сплави літію з іншими металами (кальцієм, магнієм, важкими металами). Для цього або вводять в електроліт хлорид відповід-ного металу, або ведуть електроліз з розчинною анодом з металу - компонента сплаву з літієм.
Отримання літію вакуумгерміческімі методами
Електролітичним методом отримання літію має визна-лені недоліки: вихідний хлорид літію щодо до-ріг. Внаслідок близькості потенціалів виділення літію, калію і натрію електролітичний літій містить помітну кількість домішок калію і натрію, що вимагає його до-полнительной очищення. Необхідно поглинання або утилізуються-ція виділяється на аноді хлору. У зв'язку з цим розробити конструкцію тани варіанти вакуумтерміческіх методів отримання літію відновленням з оксиду літію, моноалюміната (Li20 А1203), а також безпосередньо з сподумена.
Відновлення оксиду літію. Оксид літію отримують тер-мическим розкладанням карбонату літію. При 810, 890 і 1270 ° С тиск С02 над карбонатом літію дорівнює 2; 4,3 і 101 кПа (15, 32 і 760 мм рт. Ст) відповідно. Щоб в процесі розкладання карбонату літію не відбувалося його розплавлення (температура плавлення Li2C03 735 ° С), що ускладнювало б видалення С02, оксид літію отримують Прокаєв-ням брикетованої суміші Li2C03 і СаО (при співвідношенні-ванні 1: 1,5 за масою) при 850 ° С у вакуумі (для зсуву ре-акції в сторону виділення С02). В результаті отримують суміш Li20 з СаО. Остання, як показано нижче, є корисним компонентом шихти.
Як доступного відновника оксиду літію при-міняють порошкоподібний кремній:
2Li20 + Si = Si02 + 4Li (10.5)
При стандартних умовах реакція (10.5) характеризує-ся позитивною зміною енергії Гіббса і є ен-дотерміческой:
ДС »8К = 298 кДж, ДВ ° 298К = 320 кДж.
Отже, реакція (10.5) може протікати при по-щення температурах у вакуумі з відгонкою газоподібного літію зі сфери реакції. Однак в цих умовах частина ок-сіда літію зв'язується в ортосілікат:
4Li20 + Si = 4Li (ra3) + Li4SiQ4. (10.6)
Присутній у вихідній шихті оксид кальцію запобігання утворення-ращает цю реакцію, пов'язуючи Si02 в ортосілікат кальцію:
Li4Si04 + Si + 4СаО = 4Li (ra3) + 2Ca2Si04; (Ю.7)
Д ^ іооок = -351 кДж.
Прокаленную суміш літію і кальцію подрібнюють, змішуючи-ють з порошком кремнію (надлишок 10% проти розрахункового ко-лічества) і брикети з цієї суміші нагрівають у вакуумній печі при 1000 - 1300 ° С і тиску в печі 0,113 Па. Літій збирається в конденсаторі. Вихід літію при 1000 ° С - 75%, при 1300 ° С - до 93%. Основні домішки: 0,04% Са і 0,01% Si.
Відновлення алюмінату літію. Літій високої чистоти з виходом 95 - 98% можна отримати відновленням моно-Люмінаті літію алюмінієм у вакуумі при 1150 - - 1200 ° С. Алюмінат літію отримують прожарювання суміші Li2C03 з А1203.
Відновлення протікає по реакції:
3 (Li20 • А1203) + 2A1 = 6Li (ra3) + 4Al203. (Ю.8)
Рівноважний тиск літію для цієї реакції при 1100 ° С дорівнює 33,3 Па. Отже, відновлення мож-но проводити при 1200 ° С і залишковому тиску близько 13,3 Па. Для досягнення високого вилучення літію примі-няют надлишок алюмінію. Відновлення алюмінату літію не вимагає введення в шихту оксиду кальцію, що забезпечує отримання металу більш високої чистоти.
Утворений в результаті відновлення оксид алюмінію-ня використовують для отримання алюмінату літію.
Для очищення літію від механічних домішок використовують переплавку і відстоювання під шаром вазелінового або пара-фінів масла, а також фільтрування рідкого літію через сітчасті або дротові фільтри з заліза, титану або молібдену. Порошкоподібні або губчасті титан і цирконій, уран можуть служити поглиначами кисню та азоту з розплавленого літію. Ці метали практично не розчиняється-ми в літії.
Очищення від інших лужних металів ведуть, використовуючи розходження в термічної стійкості гідридів. Тиск дисоціації гідридів LiH, КН та NaH досягає 0,1 МПа (1 ат.) При 850, 427 і 420 ° С відповідно. Температура плавлення гідриду літію 688 ° С. При нагріванні літію в водні при 700 - 800 ° С калій і натрій випаровуються і ос-шається LiH, який потім розкладається нагріванням в вакуум-розумі. Сильно забруднене літій, наприклад, отриманий вос-становленням сподумена, може бути очищений електролітічес-ким рафинированием.
Ефективний метод рафінування літію дистиляцією в вакуумі. Спочатку при 450 ° С відганяють основну кількість домішок лужних металів (калію, натрію). Літій потім випаровують при 600 - 800 ° С під тиском 1,3 • Ю-3 Па (
Заходи безпеки, упаковка і зберігання літію
При плавці і розливанні літію на повітрі можливо його загоряння. Який загорівся метал рекомендується засипати су-хім хлористим натрієм, хлористим літієм, содою (НЕ Бікар-Бонато) або сумішшю, що складається з інертного порошку (гра-фіт, хлорид натрію), 10 - 20% в'язких органічних речовин (смола, змішана з поліетиленом) і добавок стеарил - тов і тальку. Літій випускають у вигляді злитків, гранул, прутків, дроту. Зберігають літій в герметичній залізної тарі під шаром пастоподібної маси з парафіну і міні-рального масла або під газоліном або петролейним ефіром, що заповнюють тару доверху. Перед застосуванням літію міні-ральное масло змивають петролейним ефіром або бензолом, які потім випаровують у вакуумі. Зручно зберігати літій, запрессовивая його в герметичні тонкостінні трубчасті алюмінієві або мідні оболонки, від яких потім можна відрізати потрібні шматки літію.