Термодинамічна фаза термодинамічно однорідна за властивостями частина термодинамічної системи, відокремлена від інших фаз поверхнями розділу, на яких стрибком змінюються деякі властивості системи 1.
У однокомпонентной системі різні фази можуть бути представлені різними агрегатними станами або різними поліморфними модифікаціями речовини. У багатокомпонентної системі фази можуть мати різний склад і структуру.
Газ завжди складається з однієї фази, рідина може складатися з декількох рідких фаз різного складу, але двох різних рідин одного складу в рівновазі співіснувати не може. Речовина в твердому стані може складатися з декількох фаз, причому деякі з них можуть мати однаковий склад, але різну структуру (поліморфні модифікації, аллотропия).
Агрегатний стан-стан речовини, що характеризується певними якісними властивостями - здатністю або нездатністю зберігати обсяг і форму, наявністю або відсутністю далекого і ближнього порядку і іншими.
Зміна агрегатного стану супроводжується стрибкоподібним зміною вільної енергії, ентропії, густини і інших основних фізичних властивостей. Виділяють наступні агрегатні стани: тверде тіло, рідина, газ, плазма.
Набір термодинамічних фаз речовини звичайно значно багатший набору агрегатних станів, тобто один і той же агрегатний стан речовини може знаходитися в різних термодинамічних фазах (лід, наприклад, зустрічається в п'яти різних модифікаціях - фазах). Саме тому опис речовини в термінах агрегатних станів досить огрублённое, і воно не може розрізнити деякі фізичні різні ситуації.
У будь-якому випадку при наявності розділу фаз мається на увазі принципова можливість переходу речовини з однієї фази в іншу.
Фазовий перехід (фазове перетворення) в термодинаміки - перехід речовини з однієї термодинамічної фази в іншу при зміні зовнішніх умов.
Значення температури, тиску або будь-якої іншої фізичної величини, при якому відбуваються фазові переходи в однокомпонентної системі, називають точкою переходу.
Прикладом фазового пе-рехода можуть служити зміни агрегатного стану речовини або переходи, пов'язані зі змінами в складі, ладі-ванні і властивості речовини (наприклад, пе-реход кристалічної речовини з од-ної модифікації в іншу).
Оскільки поділ на термодинамічні фази - більш дрібна класифікація станів, ніж поділ по агрегатним станам речовини, то далеко не кожен фазовий перехід супроводжується зміною агрегатного стану. Однак будь-яка зміна агрегатного стану є фазовий перехід.
Розрізняють фазові переходи двох родів.
Фазовий перехід першого роду (наприклад, плавлення, кристалізація і т.д.) супроводжується поглинанням або виділенням теплоти, званої теплотою фазового переходу.
При фазовому переході першого роду стрибкоподібно змінюються найголовніші, первинні екстенсивні параметри: питома обсяг, кількість запасеної внутрішньої енергії, концентрація компонентів і т. П.
Найбільш поширені приклади фазових переходів першого роду: плавлення і кристалізація, випаровування і конденсація, сублімація і десублімації.
Фазові переходи першого роду характеризуються постійністю температури, змінами ентропії і обсягу. Пояснення цьому можна дати наступним чином.
Під стрибкоподібним зміною властивостей речовини мається на увазі стрибок при зміні температури і тиску. В реальності ж, впливаючи на систему, ми змінюємо не оці величини, а її обсяг і її повну внутрішню енергію. Ця зміна завжди відбувається з якоюсь кінцевою швидкістю, а значить, що для того, щоб «покрити» весь розрив в щільності або питомої внутрішньої енергії, нам потрібен якийсь кінцевий час. Протягом цього часу фазовий перехід відбувається не відразу у всьому обсязі речовини, а поступово. При цьому в разі фазового переходу першого роду виділяється (або забирається) певну кількість енергії, яка називається прихованою теплотою фазового переходу. Для того, щоб фазовий перехід не зупинявся, потрібно безперервно відводити (або підводити) це тепло, або компенсувати його вчиненням роботи над системою.
Наприклад, при плавленні тілу потрібно повідомити деяку кількість теплоти, щоб викликати руйнування кристалічної решітки. Підводиться при плавленні теплота йде не на нагрів тіла, а на розрив міжатомних зв'язків, тому плавлення протікає при постійній температурі. При подібних переходах - з більш упорядкованого кристалічного стану в менш впорядковане рідкий стан - ступінь безладдя збільшується і, з точки зору другого закону термодинаміки, цей процес пов'язаний зі зростанням ентропії системи. Якщо перехід відбувається в зворотному напрямку (кристалізація), то система теплоту виділяє.
Фазові переходи, не пов'язані з по-глощеніем або виділенням теплоти і зміною обсягу, називаються фазовими переходами другого роду.
Ці переходи характеризуються постійністю об'єму і ентропії. При цьому щільність і внутрішня енергія так само не змінюються, так що неозброєним оком такий фазовий перехід може бути непомітний. Стрибок ж відчувають їх похідні по температурі і тиску: теплоємність, коефіцієнт теплового розширення, різні сприйнятливості і т. Д.
Загальна трактування фазо-вих переходів II роду запропонована радянським ученим Л. Д. Ландау (1908-1968). Відповідно до цієї трактуванні, фазові переходи II роду пов'язані зі зміною сіммет-рії: вище точки переходу система, як правило, має більш високу сіммет-рией, чим нижче точки переходу.
Найбільш поширені приклади фазових переходів другого роду: проходження системи через критичну точку, перехід парамагнетик-феромагнетик або парамагнетик - антиферромагнетик, перехід металів і сплавів в стан надпровідності, перехід рідкого гелію в надтекучий стан, перехід аморфних матеріалів в склоподібний стан.
Сучасна фізика досліджує також системи, що володіють фазовими переходами третього або більш високого роду. Останнім часом широкого поширення набуло поняття квантовий фазовий перехід, тобто фазовий перехід, керований не класичний тепловими флуктуаціями, а квантовими, які існують навіть при абсолютному нулі температур.
Розподіл фазових переходів на два роду кілька умовно, так як бувають фазові переходи першого роду з малими стрибками параметра порядку і малими теплотамі переходу при сильно розвинених флуктуаціях. Це найбільш характерно для переходів між рідкокристалічними фазами.
Плавлення твердих тіл
Прикладом фазового переходу першого роду є плавлення та кристалізація твердих тіл. Процес плавлення грає важливу роль в природі (плавлення снігу і льоду на поверхні Землі, плавлення мінералів в її надрах і т.д.) і в техніці (виробництво металів і сплавів, лиття в форми та ін.).
Плавленіе- це процес переходу тіла з кристалічного твердого стану в рідке.
Головними характеристиками плавлення чистих речовин є температура плавлення (Тпл) і теплота (теплота плавлення Qпл), яка необхідна для здійснення процесу плавлення.
У процесі плавлення температура кристала залишається постійною. Ця температура і називається температурою плавлення Тпл. . У кожного речовини своя температура плавлення. Температура плавлення для даної речовини залежить від атмосферного тиску. Найвищу температуру плавлення серед чистих металів має вольфрам (3410 ° С), найнижчу -
ртуть (-38,9 ° С).
Сталість температури пояснюється тим, що при плавленні вся підводиться теплота йде на розупорядкування регулярного просторового розташування атомів (молекул) у кристалічній решітці. Для більшості кристалів (крім води, і деяких сплавів) температура плавлення зростає зі збільшенням зовнішнього тиску, так як для віддалення атомів один від одного при більшому тиску потрібна велика енергія теплових рухів, т. Е. Більш висока температура.
Розплавлене речовина володіє великим запасом внутрішньої енергії, ніж в твердому стані. Частина, що залишилася теплоти плавлення витрачається на здійснення роботи по зміні обсягу тіла при його плавленні. При плавленні обсяг більшості кристалічних тіл збільшується (на 3-6%), а при твердінні зменшується. Але, існують речовини, у яких при плавленні обсяг зменшується, а при твердінні - збільшується. До них відносяться, наприклад, вода і чавун, кремній і деякі інші. Саме тому лід плаває на поверхні води, а твердий чавун - у власному розплаві.
Плавлення починається при досягненні кристалічною речовиною Тпл. З початку плавлення до його завершення температура речовини залишається постійною і рівною Тпл, незважаючи на повідомлення речовини теплоти (рис. 1). Нагріти кристал до Т> Тпл в звичайних умовах не вдається, тоді як при кристалізації порівняно легко досягається значне переохолодження розплаву.
Плавлення відбувається з поглинанням прихованої теплоти фазового переходу - теплоти плавлення Qпл ..
Питома теплота плавлення qпл. показує, яка кількість теплоти необхідно для повного перетворення 1 кг речовини з твердого стану в рідке, взятого при температурі плавлення. qпл. = Qпл. / M, Дж / кг.
Плавлення супроводжується зміною фізичних властивостей речовини: збільшенням ентропії, що відображає розупорядкування кристалічної структури речовини; зростанням теплоємності, електричного опору. Практично до нуля падає при плавленні опір зрушенню, зменшується швидкість поширення звуку (подовжніх хвиль) і т.д.
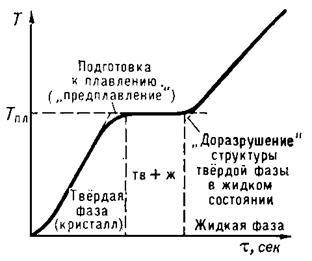
Мал. 1. Зупинка температури при плавленні кристалічного тіла.
По осі абсцис відкладено час # 964 ;, пропорційне рівномірно що підводиться до тіла кількості теплоти.
Згідно молекулярно-кінетичних уявлень, плавлення здійснюється наступним чином. При підведенні до кристалічного тіла теплоти збільшується енергія коливань (амплітуда коливань) його атомів, що призводить до підвищення температури тіла і сприяє утворенню в кристалі різного роду дефектів (незаповнених вузлів кристалічної решітки - вакансій; порушень періодичності грат атомами, що упровадилися між її вузлами, і ін . У молекулярних кристалах може відбуватися часткове розупорядкування взаємної орієнтації осей молекул, якщо молекули не володіють сферичної формою. Поступове зростання числа дефектів їх об'єднання характеризують стадію передплавлення. З досягненням Тпл в кристалі створюється критична концентрація дефектів, починається плавленіе- кристалічна решітка розпадається на легкорухливі субмикроскопические області. Подводимая при плавленні теплота йде не на нагрів тіла, а на розрив міжатомних зв'язків і руйнування далекого порядку в кристалах. В самих же субмикроскопических областях ближній порядок в розташуванні атомів при плавленні істотно не змінюється. Цим пояснюються менші значення теплот плавлення Qпл в порівнянні з теплотамі пароутворення і порівняно невелика зміна ряду фізичних властивостей речовин при їх плавленні. У міру зростання температури молекули рухаються все інтенсивніше. При нагріванні зростає не тільки молекулярно-кінетична енергія тіла, але і потенційна енергія взаємодії його атомів, оскільки при збільшенні амплітуди коливань атоми відходять один від одного на більшу відстань і зближуються на меншу відстань, завдяки чому енергія взаємодії їх електричних зарядів зростає. З підвищенням температури настає, нарешті, такий момент, коли підтримання порядку серед сильно розгойдуються атомів стає неможливим, і з цього моменту починається руйнування кристалічної решітки, в результаті чого зникає і дальній порядок. Тверде тіло плавиться.
У аморфних тіл зміна температури з часом не має ділянки з постійною температурою, а тільки точку перегину. Збільшення температури твердого аморфного тіла супроводжується безперервним зменшенням його в'язкості.
Зворотний перехід речовини в твердий стан можливий як з рідкого, так і з газоподібного стану. І в тому і в іншому випадку такий перехід здійснюється зі стану, позбавленого симетрії, в стан, в якому симетрія існує (це відноситься до дальнього порядку, який має місце в кристалах і якого немає ні в рідинах, ні в газах). Тому перехід в твердий стан повинен відбуватися стрибком при певній температурі, на відміну від переходу рідина-пар, який може відбуватися безперервно. Процес утворення твердого тіла при охолодженні рідини є процес утворення кристала (кристалізація) і відбувається він при певній температурі - температурі кристалізації. Так як при такому перетворенні енергія системи зменшується, то такий перехід повинен супроводжуватися виділенням енергії у вигляді теплоти кристалізації. Із закону збереження енергії випливає, що теплота плавлення і теплота кристалізації повинні бути рівні один одному.