Освіта твердої фази (кристалізація) - складний процес, що складається з декількох стадій.
1. Дегідратація іонів, що утворюють осад. Іони в розчині гідратованих, тверда фаза в багатьох випадках не містить води, тому іони перед освітою кристала повинні втратити гідрадну воду.
2. Освіта первинних центрів кристалізації. Два іона протилежного знаку, об'єднуючись в молекулу, не утворюють ще кристалічної форми. Освіта первинного кришталика проходить через ряд проміжних стадій. Так, при осадженні сульфату барію з пересичених розчинів відбуваються такі процеси:
Ва 2 + SO4 2- ↔ Ba 2+ SО4 2 - освіту іонної пари;
Це так званий індукційний період.
Таким чином, для утворення первинного кристала в будь-якій точці розчину повинні об'єднуватися між собою принаймні по кілька іонів протилежного знака. Тільки в цьому випадку може утворитися первинний кристалик (зародок), наприклад, кубічної форми.
3. Зростання первинних центрів кристалізації за рахунок осадження на них все більшої кількості іонів, в результаті чого утворюються кристали більшого розміру, які об'єднуються між собою в більші агрегати, які не здатні, однак, ще виділитися з розчину у вигляді осаду. Це - колоїдна стадія освіти нерозчинного з'єднання.
4. Освіта протягом деякого часу в розчині настільки великих кристалів або їх агрегатів. що вони не можуть більше утримуватися в розчині, і, нарешті, відбувається виділення твердої фази (осаду).
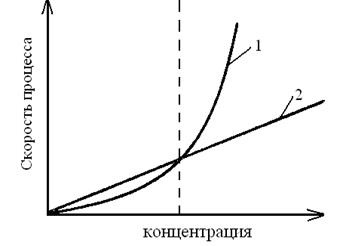
Мал. 3.1. Залежність швидкостей утворення зародків (1)
і їх зростання (2) від відносного пересичення
Утворилися опади можуть відрізнятися за своїми властивостями. В одних випадках виділяються аморфні опади, в інших - кристалічні.
Характер осаду залежить від співвідношення швидкостей двох процесів: швидкості утворення зародків - первинних центрів кристалізації # 965; 1 і швидкості росту розмірів зародків # 965; 2. значення # 965; 1 і # 965; 2 визначаються відносним пересиченням, що виникають при додаванні розчину осадителя.
Мірою пересичення розчину є ступінь пересичення R, яка визначається виразом:
де С- концентрація осаждаемого речовини, яка виходить при внесенні осадителя;
S - рівноважна розчинність осаду в даних умовах
Зазвичай при малих значеннях відносного пересичення # 965; 2> # 965; 1 при його зростанні швидкості обох процесів стають в певний момент часу рівними, і, нарешті, швидкість # 965; 1 починає переважати, т. Е. # 965; 2 стає менше # 965; 1.
На рис. 3.1 видно, що при малих значеннях відносного пересичення (ліва частина малюнка) переважає швидкість росту зародків, а при великих значеннях (права частина малюнка) переважає швидкість утворення нових зародків.
Розглянуті залежності пояснюють, чому в одних випадках утворюються аморфні, а в інших - кристалічні опади.
При додаванні розчину осадителя в перший момент часу утворюється пересичений розчин труднорастворимого речовини. Якщо речовина мало розчинно, то досягається велика відносне пересичення і швидкість утворення зародків значно більше, ніж швидкість їх росту. У цих умовах при додаванні наступних порцій розчину осадителя утворюється велика кількість нових центрів кристалізації. Ці первинні зародки злипаються в більші агрегати і виділяються з розчину у вигляді аморфного осаду.
Навпаки, якщо розчинність речовини не дуже мала, відносне пересичення менше, ніж в першому випадку, і після додавання розчину осадителя утворюється порівняно мало зародків, розміри яких швидко збільшуються. З розчину виділяються окремі кристали досить значних розмірів - утворюється кристалічний осад.
Аморфні опади складаються з безлічі слабо пов'язаних між собою дуже дрібних кристаликів. Більшість таких опадів мають кристалічну структуру, внаслідок чого їх називає також ськритокрісталлічеського.
Ступінь перенасичення розчину можна змінювати, регулюючи умови осадження.
Крупнокрісталліческій осад має переваги перед дрібнокристалічним і особливо аморфним осадом. Умови його осадження можна визначити, виходячи з величини ступеня пересичення розчину: щоб осад утворився кристалічний, необхідно зменшити ступінь пересичення R.
Відповідно до формули (3.1) для зменшення R необхідно зменшити концентрацію осаждаемого речовини (С) і збільшити його розчинність (S).
Зменшення концентрації осаждаемого з'єднання можна домогтися:
1) розведенням розчину;
2) зниженням концентрації осадителя (метод «виникає реагенту»): в розчин вводять речовину, яка при відповідній реакції, зазвичай йде з малою швидкістю, виділяє в розчин необхідний осадитель.
Збільшення розчинності осаду в процесі осадження досягають підвищенням температури або додаванням електролітів, які підвищують сольовий ефект.
Найбільш істотною характеристикою аморфних опадів є дуже велика загальна поверхня. У зв'язку з цим на поверхні аморфних опадів часто адсорбуються сторонні речовини. Крім того, в зв'язку з наявністю великої кількості дуже дрібних агрегатів, які слабо пов'язані між собою, при промиванні аморфні опади можуть утворювати колоїдні розчини.