- Загальноосвітні. формування мислення учнів через активізацію уявлень про взаємозв'язок будови речовини з його властивостями, ознайомлення учнів з історією відкриття бензолу, його фізичними і хімічними властивостями, способами отримання. Дати поняття про ароматичности, ароматичної зв'язку. Ознайомити із сучасною теорією електронної будови бензолу.
- Розвиваючі. розвиток умінь і навичок роботи з ноутбуком, з електронними виданнями, розвиток пізнавального інтересу учнів, підвищення інтелекту.
- Виховні. формування наукового світогляду, виховання вміння працювати в парах, почуття гордості за досягнення науки, прищеплення інтересу до предмета.
I. Організаційний момент
Привітання, перевірка готовності учнів до уроку, створення позитивної мотивації на майбутній урок.
II. Повторення пройдених тем (фронтальне опитування, робота учнів у дошки)- Дати визначення граничних і ненасичених вуглеводнів, охарактеризувати класифікацію речовин;
- Алкани, алкени, алкіни: порівняти тип гібридизації, валентний кут, довжину зв'язку;
- Назвати типи хімічних реакцій для вуглеводнів;
- Написати рівняння характерних реакцій для вуглеводнів.
III. Виклад нової теми
- рішення задачі на визначення молекулярної формули речовини
- способи отримання бензолу
- фізичні властивості бензолу
- вплив на організм людини
- будова бензолу - структурна формула
- сучасна теорія електронної будови бензолу
- хімічні властивості бензолу

Які асоціації викликають ці слайди?
Уявіть собі Англію початку 19 століття. Уже в 1814 році вулиці і набережні Лондона вечорами висвітлювалися газовими ліхтарями. У спеціальних пальниках вуличних ліхтарів спалювали світильний газ, що отримується з китового і тріскового жиру. Але не всі жителі туманного Альбіону були задоволені новим освітленням. Вальтер Скотт писав: "Світ перевернувся, Лондон буде висвітлюватися вугільним димом". А виробники свічок відкрито громили нові ліхтарі. До того ж у "светильного газу" був істотний недолік: в літні ночі освітлення було яскравим, а взимку в сильні холоди швидко ставало тьмяним. Газ не давав яскравого світла, тому жителям Лондона не так приємно було гуляти по набережній Темзи. Власники газового заводу звернулися за допомогою до відомого вченому М. Фарадея.
У 1825 році Фарадей встановив, що частина светильного газу збирається на дні балона у вигляді прозорої рідини. Вчений встановив якісний і кількісний склад цієї речовини і назвав його "карбюрірованним воднем", оскільки в його склад входили атоми вуглецю і водню. Назва нового речовини кілька разів змінювалося. Ейльгард Мітчерліх назвав його бензином. Незабаром Юстус Лібіх перейменував його в бензол (від араб.ben-аромат + zoa-сік + лат.ol (eum) -масло). У 1837 році з подачі Огюста Лорана з'явилося ще одна назва-фен (від греч.phenix-висвітлювати) в знак того, що бензол був виявлений в світильному газі.
Отже, ця речовина - бензол!
Сьогодні без нього не обходяться при отриманні багатьох лікарських препаратів, запашних речовин, різноманітних барвників. Воно застосовується як розчинник, як добавка до моторного палива. Велика роль похідних бензолу в сільському господарстві за умови їх раціонального застосування. І хоча нам практично не доводиться мати справу з ним, його похідні - аспірин, ванілін, ефедрин та інші - давно вже увійшли в наше життя.
Серед понад 25 млн. Відомих на сьогоднішній день органічних сполук трохи знайдеться таких, які надали на розвиток органічної хімії більший вплив, ніж бензол! Для пояснення його будови і властивостей було висунуто безліч теорій, більшість з яких не витримали випробування часом і відомі лише історикам хімії.
Бензол в органічної хімії є таким же важливим речовиною, як і сірчана кислота в неорганічної хімії. І якщо остання відома хімікам ще з найдавніших часів, то бензол був відкритий лише на початку 19 століття, на зорі народження нової хімії - саме тієї, яка лідирує в наші дні, тієї, з якою пов'язана поява різних полімерів, штучних тканин, волокон, синтетичних барвників, саме тієї, яка так круто змінила наше життя на краще.
А шлях до урізноманітнення продуктів хімії лежить саме через бензол - нічим не примітне рідина, якою і назва дали не відразу, формулу не могли визначити, а будівля була загадкою і предметом численних наукових дискусій!
Завдання: Визначити формулу речовини, відкрите Фарадеєм, якщо відомо, що в його склад входить 92, 3% вуглецю і 7,7% водню, а відносна молекулярна маса речовини дорівнює 78.

Отже, С6 Н6 -бензол-легкокипящая, безбарвна, нерозчинна у воді рідина зі своєрідним запахом.
Багато похідні бензолу також мають приємний аромат, іноді дуже приємним, тому ці вуглеводні назвали "ароматичними" (за пропозицією А.Кекуле-1860 р). Пізніше виявилося, що більшість речовин, які за будовою і за властивостями належать до цієї ж групи, не мають ароматного запаху, однак історично сформована назва цих сполук збереглося до наших днів. Бензол по праву можна вважати родоначальником цих сполук.
Бензол погано впливає на організм людини: викликає ураження кровоносної та нервової систем, шлунково-кишкового тракту. Він є канцерогеном, тобто речовиною, яке при багаторазовому контакті з організмом сприяє зростанню злоякісних пухлин. Особливо сильно цей вплив на молодий організм. Таким чином, незважаючи на величезне значення бензолу і його сполук в житті людей, він здатний принести людині шкоди!
За змістом в молекулі атомів водню було ясно, що ароматичні вуглеводні мають неграничний характер. На бензол і отримані незабаром його гомологи було зруйновано весь наявний арсенал методів дослідження, як хімічних, так і фізичних. На загальний подив, речовина не володіло схильністю до реакцій приєднання, т.е.не нагадувало алкени, а за характерними для нього реакцій заміщення схоже скоріше на алкани. Почалася захоплююча історія встановлення структурної формули бензолу.
З огляду на загальну формулу бензолу і його сильно ненасичений характер, можна скласти такі структурні ізомери:
Але яка ж з них відповідає істині? Ф.А.Кекуле довго розмірковував над структурою бензолу. Одного разу йому довелося бути свідком у судовому процесі у справі про вбивство графині Герліц. На цьому процесі як доказ демонструвалося кільце графині у вигляді двох переплетених змійок. Ці змійки врізалися в пам'ять вченого.
Зі спогадів Ф.А. Кекуле: "Моя лабораторія знаходилася в провулочку, і навіть удень там панувала напівтемрява. Для хіміка, який проводить цілі дні в лабораторії, це не стало на заваді. Я займався роботою над своїм підручником, але щось мені заважало, і мої думки десь то витали. Я повернув крісло до каміна і задрімав. Атоми вуглецю і водню почали танцювати перед моїми очима. Довгі нитки дуже часто зближалися і згорталися в трубку, нагадуючи двох змій. Але що це? Одна з них вчепилася в власний хвіст, продовжуючи насмішкувато кружляти перед моїми очима. Я раптово прокинувся і на цей раз провів залишок ночі, щоб вивчити наслідок з моєї гіпотези ".
Сон виявився віщим! Кекуле зчепив всі атоми вуглецю в шестикутник з чергуються подвійними і одинарними зв'язками.
Так була запропонована структурна формула бензолу. Понад 100 років користуються хіміки формулою Кекуле, хоча вона суперечлива. Численні факти підштовхували хіміків до думки, що в бензолі немає ні простих, ні подвійних зв'язків, а є "полуторні". Це запропонував І.Тіле вже на рубежі IX і XX ст. Він стверджував, що атоми вуглецю з'єднані простими зв'язками, а залишкові валентності рівномірно розподіляються по всьому кільцю. Дев'ять валентностей доводиться на шість атомів - ось і виходить, що зв'язку в молекулі бензолу - "полуторні". Після цього формулу бензолу стали зображати у вигляді шестикутника з кільцем.
Таке зображення виявилося більш ніж правильним. За допомогою складних фізичних спостережень було встановлено, що шість електронів від "зайвих" зв'язків (по два на одну зв'язок) утворюють єдину структуру: т.зв "єдине електронне хмара", яке і стало ознакою ароматичности з'єднання. І майже вікове дослідження бензолу завершилося.
Вивченням природи подвійних зв'язків в бензолі займалися багато видатних хіміки, поступово наближаючись до розуміння істинного будови його молекули. Сучасне уявлення про електронну природу зв'язків в бензолі грунтується на гіпотезі видатного американського фізика і хіміка Лайнуса Полінга, двічі лауреата Нобелівської премії. Саме за його пропозицією молекулу бензолу стали зображати у вигляді шестикутника з вписаною окружністю, підкреслюючи тим самим відсутність фіксованих подвійних зв'язків і наявність єдиного електронного хмари, що охоплює всі шість атомів вуглецю циклу.
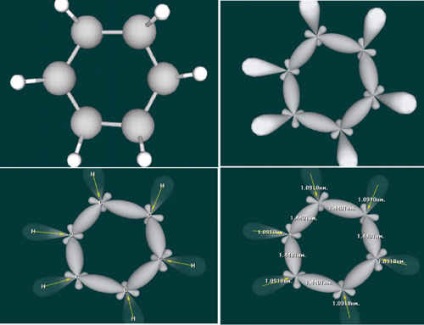
Кекуле мав рацію: молекула бензолу має циклічний будова, всі шість атомів вуглецю лежать в одній площині. Кожен атом вуглецю знаходиться в стані sp 2 - гібридизації, оскільки пов'язаний з ще двома атомами вуглецю і одним атомом водню.
Крім цього, у кожного атома вуглецю є одна p-орбіталь, яка не бере участі в гібридизації. Вона має форму об'ємної вісімки. Шість таких електронних хмар перекриваються, утворюючи єдину П-систему, в якій електронна щільність рівномірно розподілена між усіма шістьма атомами вуглецю, а отже, всі зв'язки між атомами вуглецю абсолютно однакові.
У зв'язку з цим більш точним зображенням бензолу є шестикутник з окружністю всередині.
(Учням пропонується робота з CD "Віртуальна лабораторія", розділ "Конструктор молекул". Учні збирають динамічні, тривимірні моделі молекули бензолу, розглядають структурну модель, модель з гібридними хмарами.)
Физминутку для очей після роботи з ноутбуками. (Додаток 1)
За хімічними властивостями бензол займає проміжне положення між алканами і алкенами. Так позначаються на властивостях бензолу особливості його електронної будови.
Бензол НЕ знебарвлює розчин перманганату калію. До бензолу може приєднатися хлор, але реакція протікає тільки при інтенсивному опроміненні суміші.
Реакція приєднання водню до бензолу протікає під тиском і при нагріванні.
Таким чином, реакції приєднання у бензолу протікають важче, ніж у алкенів.
А реакції заміщення протікають легше, ніж у алканів.
Бензол - найважливіша сировина для хімічної промисловості, оскільки він використовується і як вихідний реагент (практично всі сучасні синтетичні матеріали, як правило, містять ароматичні угруповання), і як розчинник для інших речовин (бензол розчиняє практично всі органічні сполуки, це свого роду "органічна вода "). Ось тільки основні синтези за участю бензолу: отримання фенолу, бензойної кислоти, аніліну, фенолформальдегидной смоли, спеціальних видів каучуку, толуолу, а, отже, і вибухових речовин (тринітротолуолу), ліків (аспірину, наприклад). Перераховувати можна дуже довго.
Бензол і його похідні знаходять широке застосування в народному господарстві.
Бензол служить вихідною сировиною для синтезу багатьох органічних сполук: ліків, запашних речовин, барвників, розчинників, полімерів. Використовується як добавка до моторного палива для поліпшення його властивостей.
Хлорпохідні бензолу використовуються в сільському господарстві в якості засобів захисту рослин, для сухого протруювання насіння пшениці та жита проти твердої сажки, для боротьби з філоксерою на виноградниках.
Питання для закріплення.- Які фізичні властивості бензолу?
- У чому полягає суперечність між структурною формулою бензолу і його властивостями?
- Структурну формулу бензолу зображують у вигляді шестикутника з окружністю всередині. Що це коло означає?
- У чому полягає схожість бензолу з алканами і алкенами?
- Дізналися багато нового.
- Було цікаво.
- Було над чим подумати.
- Попрацювали сумлінно.
- Урок сподобався.