Загальні відомості про валентності калію
Калій - перший елемент четвертого періоду. Він розташований в I групі головною (А) підгрупі Періодичної таблиці.
У вигляді простого речовини калій являє собою сріблясто-білий метал. Має об'ємно-центровану кристалічну решітку. Щільність калію невелика (легше води) - 0,86 г / см 3. Температури кипіння і плавлення також невисокі (63,6 o С і 760 o С, відповідно). М'який, легко ріжеться ножем. На повітрі калій швидко окислюється, утворюючи пухкі продукти взаємодії.
Валентність калію в з'єднаннях
Калій - знаходиться в четвертому періоді в IA групі Періодичної таблиці Д.І. Менделєєва. Порядковий номер дорівнює 19. В ядрі атома калію міститься 19 протонів і 20 нейтронів (масове число дорівнює 39). В атомі калію є чотири енергетичних рівня, на яких знаходяться 19 електронів (рис. 1).
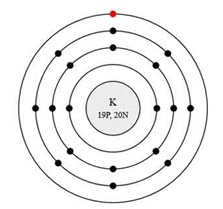
Мал. 1. Будівлі атома калію.
Електронна формула атома калію в основному стані має наступний вигляд:
А енергетична діаграма (будується тільки для електронів зовнішнього енергетичного рівня, які по-іншому називають валентними):
Наявність одного єдиного неспареного електрона свідчить про те, що калій проявляє валентність I в своїх з'єднаннях (K I 2 O, K I OH, K I Cl, K I NO3 і т.д.). Валентність калію постійна.
Приклади розв'язання задач
У поєднанні калію з киснем масова частка металу становить 44,8%. Визначте найпростішу формулу сполуки.
Припустимо, що формула сполуки калію з киснем має вигляд Kx Oy. Кількість атомів кожного елемента в молекулі пропорційно наступного відношенню:
x: y = ω (K) / Ar (K). ω (O) / Ar (O).
Масова частка кисню в оксиді дорівнює:
ω (O) = 100% - ω (K) = 100% - 44,8% = 55,2%.
x: y = 44,8 / 39. 55,2 / 16;
Отже, формула оксиду сірки має вигляд KO2 - це надпероксід калію.