АЛКОГОЛЯТИ
АЛКОГОЛЯТИ. продукти заміщення атома Н в молекулі спирту на метал (М).
Алкоголятаодноатомних спиртів. Їх загальна формула M (OR) n. де n-ступінь окислення металу. АЛКОГОЛЯТИ лужних, щел.-зем. металів, Т1 (1) і первинних спиртів-іонні сполуки; неплавки, нелеткі; т. різні 200-300 ° С; розчинний в спиртах і рідкому NH3; електроліти в розчині. З спиртових розчинів зазвичай виділяються у вигляді крісталлосольватов. Похідні металів III-VIII груп і спиртів (починаючи з С2 Н5 ОН), а також M 1 OR-mpem- молекулярні мономерні або олігомерні з'єднання; мають низькі температури плавлення і кипіння; добре розчинний в неполярних розчинниках, погано-в спиртах; розчини не проводять струм. Метилат тих же елементів-зазвичай координац. полімери; неплавки, нелеткі; не розчин. ні в одному з розчинників. Більшість АЛКОГОЛЯТИ елементів середини періодичної системи поєднують властивості іонних і молекулярних сполук (див. Табл.). Все АЛКОГОЛЯТИ дуже гігроскопічні.
ХАРАКТЕРИСТИКА алкоголятов [М (ОН) n] m
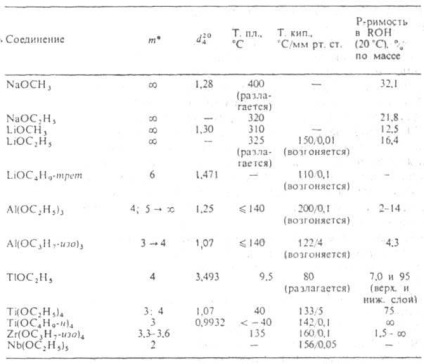
* Т-ступінь асоціації; стрілкою показано зміна т при старінні.
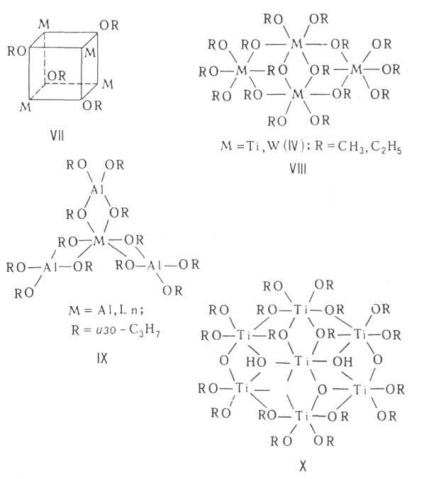
З подовженням R в гомологічен. рядах температура плавлення, щільність, показник заломлення, розчинність в спирті зазвичай знижуються, а температура кипіння (сублімації), Н іS випаровування, в'язкість збільшуються. Просторів. труднощі, зростаючі при переході від первинних R до вторинних і третинних, перешкоджають асоціації молекул. У цьому ж ряду знижуються температура кипіння (див. Рис. 1), в'язкість і зростає розчинність в неполярних розчинниках. АЛКОГОЛЯТИ ряду багатовалентних металів, наприклад Al, Ga, Ti, Fe (III), утворюють кілька ассоциатов різні складу і будови (наприклад, формули VI і IX). Їх олігомерні і полімерні молекули здатні до взаємних перетворюються, тому фізичних-хімічний властивості і реакційний здатність окремих препаратів АЛКОГОЛЯТИ можуть змінюватися в досить широких межах (див. Рис. 2).
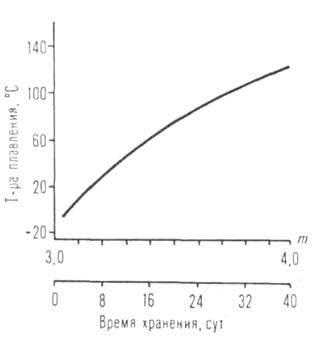
Мал. I. Залежність температури кипіння ізомерних амілатов Ti, Mb, Al, U від розгалуженості R.
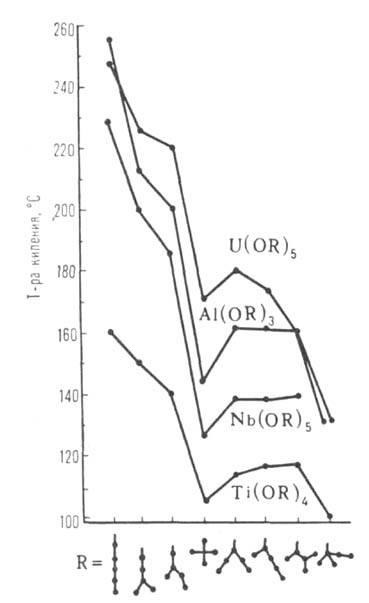
Мал. 2. Залежність температури плавлення [Al (ОС3 Н7 -ізо) з] т від ступеня асоціації (т) і часу зберігання (з моменту початку кристалізації).
Будова ассоциатов визначається принципом "мінім. Ступеня полімеризації", згідно з яким всі атоми М досягають стійких координац. чисел (завдяки донорно-акцепторного взаємодія між вільний орбиталями М і парами електронів атомів Про алкоксильной груп сусідніх молекул). АЛКОГОЛЯТИ мономірним тільки в разі полідентатних або дуже розгалужених алкоксілов (див. Формули I, II). Асоціати можуть мати різноманітне будова. Димери здатні утворити структуру з двох багатогранників, наприклад тетраедрів (III) або октаедрів (IV) із загальним ребром (OR) 2. кластери Мо або W, що містять кратні зв'язки М-M (V). Молекули тримерів є зазвичай циклоли-лінійні ланцюжка (VI), тетрамеров-Куба (ТЮСН3. КОС4 Н9-третє, CH3 ZnOCH3. VII), плоскі молекули з чотирьох октаедрів з загальними ребрами (VIII) або молекули з центральним октаедром і трьома тетраедрами по його ребрах (IX). Метилат, етілат і ізопропілата лужних і щел.-зем. металів утворюють полімерні кристалічної. структури з шарів тетраедрів (типу анти-РbО) і октаедрів [типу Са (ОН) 2] відповідно.
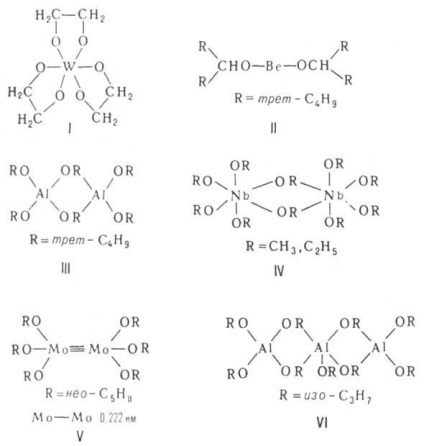
Комплексоутворення з спиртами, що супроводжується виділенням стійких крісталлосольватов [наприклад, LiOCH3 * 2CH3 OH, т. Різні 28 ° С; NaOC2 H5 * 2C2 H5 OH, т. Різні 200 ° С; Са (ОС2 Н5) 2 * nС2 Н5 ОН, де п = 4 і 2, т. Різні 60 і 100 ° С], властиво головним чином АЛКОГОЛЯТИ лужних і щел.-зем. металів; в разі багатовалентних металів сольвати зі спиртами та ін. підставами Льюїса малостійкі, так як акцепторная функція М задовольняється завдяки освіті міцних OR-містків в молекулах ассоциатов. Відомі сольвати [М (ОС3 Н7 -ізо) 4 * L] 2. де М = Sn, Zr; L = = з-С3 Н7 ОН, ТГФ, піридин, 2Ti (OR) 4 * En, 2Al (ОС3 Н7 -ізо) 3 * Еn [En = (- CH2 NH2) 2], легко піддаються десольватації. Разом з тим Al [OCH (CF3) 2] 3 * L [L = (C2 H5) 2 O, (C2 H5) 3 N, (C2 H5) 3 P] перегоняются в вакуумі без розкладання.
При взаємодія двох різні АЛКОГОЛЯТИ в розчині або розплаві утворюються біметалічни. А. (алкоксосолі Меєрвейна), для яких більш характерні властивості молекулярних з'єднання, ніж для компонентів, що утворюють їх. Так, Mg [Al (OC2 H5) 4] 2 на відміну від полімерних етілат Mg і Al необмежено розчинний в органічних розчинниках, переганяється при 195 ° С / 0,1 мм рт.ст. (Температура плавлення 181 ° С), утворює димери, вельми стійкі в газовій фазі і розчині. Комплексоутворення АЛКОГОЛЯТИ з галогенідами металів призводить до алкоксогалогенідам -М (OR) n Halm. Ангідриди мінеральних кислот при взаємодії з АЛКОГОЛЯТИ утворюють солі алкілованих кислот:
де ЕХ2 = СО2. SO2. CS2; M = Na, Сі. АЛКОГОЛЯТИ типу (з-RO) 3 Mo = Mo (OR-з) 3 оборотно зв'язує СО, СО2 і необоротно - О2. NO, C2 H2; приєднані ліганди L (за винятком О2 і NO) стають мостіковимі:
З з'єднання, що містять активний атом Н, АЛКОГОЛЯТИ вступають в реакцію обміну: М (OR) n + п НХ -> МХn + n ROH, де X = Hal, ОН, OR, SH, NH2 та ін. Реакцію широко застосовують в синтезі безводних неорганічне і органічне похідних металів, так як єдиний побічний продукт в цьому випадку-спирт.
При контрольованому гідролізі АЛКОГОЛЯТИ багатовалентних металів слідами вологи кристалізують продукти, що містять оксо-містки (див. Наприклад, формулу X). Кінцеві продукти гідролізу АЛКОГОЛЯТИ - гідроксиди; вони відрізняються високою реакційний здатністю, утворюють стійкі гідрогелю та дегидратируются при досить низьких температурах з утворенням дрібнодисперсних оксидів.
У окісліт.-відновить. реакції, що супроводжуються зміною ступеня окислення М, вступають в основні АЛКОГОЛЯТИ перехідних металів (реакцію використовують для отримання А. тих же металів в нових ступенях окислення). АЛКОГОЛЯТИ лужних або щел.-зем. металів отримують взаємодія металу зі спиртом. Іноді цю реакцію проводять в розчині вуглеводню або рідкого NH3. Берилій, Al, Y, Ln реагують зі спиртами в присутності HgCl2. I2. HHal або галогенідів тих же металів. Алкоголяти Ge, Ti, Zr, Nb, Та, Y, Sc і La отримують анодним окисленням металу в спирті в присутності електропровідної добавки [R4 N] Br. Алкоголяти лужних, щел.-зем. металів, T1 (I), V (V), Mo (VI), Re (VII), Os (VIII) отримують також Алкоголиз їх оксидів або гідроксидів:
Рівновага зміщують вправо зв'язуванням або видаленням води відгонкою. Досить універсальний метод синтезу АЛКОГОЛЯТИ Алкоголиз ряду з'єднання:
де X = Н, R », NH2. NR2. N [Si (CH3) 3] 2 - Однак застосування цього методу обмежена труднощами синтезу МХn. А. синтезують також алкоксілірованіем хлоридів металів лужними АЛКОГОЛЯТИ або сумішшю NH3 з ROH, зазвичай в спиртовому або спирто-бензольному розчині, наприклад:
де М = Na, Li, NR4; n3. У синтезі розчинних АЛКОГОЛЯТИ використовують NaOR (NaCl випадає в осад), в синтезі нерозчинних, наприклад мeтілaтoв, -LiOR (LiCl розчинний в СН3 ОН). Реакція протікає через освіту біметалічни. АЛКОГОЛЯТИ Модифікація методу - взаємодія легкодоступних пірідініевих солей хлорометаллатов з NH3.
де Ру = піридин, М = Zr, Ce (IV), Pu (IV), UO 3 +. UO2 2+. Рівновага "переетерифікації" АЛКОГОЛЯТИ ін. Спиртом: М (OR) n + п R »OHМ (OR») n + п ROH зрушують вправо відгонкою азеотропа ROH з бензолом або багаторазовим введенням нових порцій ROH. У разі близьких температур кипіння обох спиртів доцільна заміна ROH складним ефіром:
АЛКОГОЛЯТИ ряду перехідних металів може бути отримані окісліт.-відновить. реакціями, наприклад окисленням Cr (OR-трет) 3 киснем, бромом або Рb (СН 3 СОО) 4 до Cr (OR-трет) 4. Окислювачами служать складні ефіри, наприклад U (OR) 5 перетворюються при їх дії в U (OR) 6. Відновлення (NH4) 2 CrO4 в спиртовому розчині під дією УФ-опромінення призводить до Cr (OR) 3; Ti (OR) 4 відновлюється металеві. До до Ti (OR) 3. АЛКОГОЛЯТИ одноатомних спиртів використовують для селективного відновлення групи С = О (див. Меервепна-Понндорфа-Верлея реакція, Оппеіауера реакція), як каталізатори диспропорционирования альдегідів (див. Тищенко реакція), конденсації, полімеризації і ін. Лужні АЛКОГОЛЯТИ-алкоксілірующіе агенти (див. Вільямсона синтез). Алкоголяти Al і Ti-гідрофобізатори змішувальні агенти для епоксидних і поліефірних смол, кремнійорганічних полімерів. Продукти часткового гідролізу і піролізу АЛКОГОЛЯТИ-поліорганометаллоксани-компоненти термостійких покриттів. З АЛКОГОЛЯТИ в результаті їх гідролізу, піролізу або окислення отримують високочисті і активні оксиди металів.
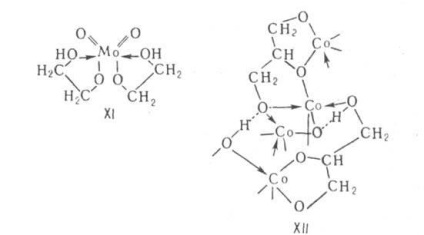
Алкоголяти гликолей і багатоатомних спиртів. Наїб. вивчені АЛКОГОЛЯТИ гліцерину (гліцерати) і АЛКОГОЛЯТИ гликолей (гликолятов). АЛКОГОЛЯТИ багатоатомних спиртів і гліколів -хелати (мономерні, олігомерні) або полімери, що містять полідентатними ліганди. Хелати зустрічаються найчастіше серед АЛКОГОЛЯТИ з не повністю заміщені групами ОН в вихідному спирті (наприклад, формула XI). Такі АЛКОГОЛЯТИ схильні до утворення сольватов з будь-якими спиртами. Являють собою гігроскопічні кристали; похідні лужних і щел.-зем. металів розчинний в спиртах, розкладаються нижче 200 ° С, похідні многова-. лентних металів (Со, Ti або ін.) розчин. також в неполярних розчинниках, летких і низькоплавких. Повністю заміщені АЛКОГОЛЯТИ-аморфні полімери, рідше-кристалічні (наприклад, гліцерат З формули XII). На відміну від M (OAlk) n вони стійкі до гідролізу, нерозчинні, неплавки, термостійкі.
Однозаміщені АЛКОГОЛЯТИ утворюються дією на багатоатомні спирти і діоли надлишку лужного, щел.-зем. металу або MOAlk; повністю заміщені АЛКОГОЛЯТИ тих же металів-диспропорціонування при високих температурах:
2NaO (CH2) 2 OH NaO (CH2) 2 ONa + АЛЕ (СН 2) 2 ОН
Двохзаміщені гликолятов і тризаміщені гліцерати багатовалентних металів отримують взаємодія оксидів, гідроксидів, М (ОAlк) n. оксалатів, ацетатів відповідно з гликолем або гліцерином при температурах вище 250 ° С.
Особливий клас - пірофорні продукти взаємодія СО з лужними або щел.-зем. металами (вважалися раніше "солями гексаоксібензола"). Вони являють собою двохзаміщені похідні гіпотетічен. ацетілендіола НОССОН.
Хімічна енциклопедія. Том 1 >> До списку статей