ВОДА (оксид водню) Н2 О, молекулярна маса 18,016, найпростіше стійке з'єднання водню з киснем. Рідина без запаху, смаку і кольору.
Поширення в природі. Вода - одне з найпоширеніших на Землі сполук. Молекули води виявлені в міжзоряному просторі. Вода входить до складу комет, більшості планет сонячної системи і їх супутників. Кількість води на поверхні Землі оцінюється в 1,39 * 10 18 т, велика частина її міститься в морях і океанах. Кількість доступних для використання прісних вод в річках, озерах, болотах і водосховищах становить 2 * 10 4 т. Маса льодовиків Антарктики, Антарктиди і високогірних районів 2,4 * 10 16 т, приблизно стільки ж є підземних вод, причому тільки невелика їх частина - прісні. У глибинних шарах Землі міститься значно більше (очевидно, не менше, ніж на порядок) води, ніж на поверхні. В атмосфері знаходиться ок. 1,3 * 10 13 т води. Вода входить до складу багато мінералів і гірських порід (глини, гіпс і ін.), Присутній в грунті, є обязат. компонентом всіх живих організмів.
Будова молекули і фізичні властивості. Атоми водню і кисню в молекулі води розташовані в кутах рівнобедреного трикутника з довжиною зв'язку О-Н 0,0957 нм; валентний кут Н-О-Н 104,5 °; дипольний момент 6,17 * 10 -30 Кл * м; поляризованість молекули 1,45 * 10 -3 нм 3; середній квадрупольний момент - 1,87 * 10 -41 Кл * м 2. енергія іонізації 12,6 еВ, спорідненість до протону 7,1 еВ. При взаємодія молекули води з ін. Атомами, молекулами і іонами, в т.ч. з іншими молекулами води в конденсується. фазах, ці параметри змінюються.
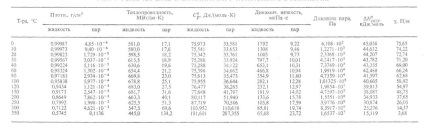
Деякі параметри, що характеризують властивості води в різних агрегатних станах при атм. тиску, наведені нижче (див. також табл. 1 і рис. 1, на якому вказані області існування різні модифікацій льоду):

Фіз. властивості води аномальні. Плавлення льоду при атм. тиску супроводжується зменшенням об'єму на 9%. Температурний коефіцієнт об'ємного розширення льоду і рідкої води від'ємний при т-pax відповідно нижче -210 ° С і 3,98 ° С. Теплоємність С ° при плавленні зростає майже вдвічі і в інтервалі 0-100 ° С майже не залежить від температури (мається мінімум при 35 ° С). Мінімум з-термодинамічно стисливості (44,9 * 10 -11 Па -1), що спостерігається при 46 ° С, виражений досить чітко. При низькому тиску і температурах до 30 ° С в'язкість води з ростом тиску падає. Високі діелектрична проникність і діпол'ний момент води визначають її хорошу розчиняють здатність по відношенню до полярних і йоногенних речовин. Завдяки високим значенням С °, і вода-важливий регулятор климатич. умов на землі, стабілізуючий температуру на її поверхні. Крім того, близькість кута Н-О-Н до тетраєдраїческому (109 ° 28 ») обумовлює рихлість структур льоду і рідкої води і, як наслідок, аномальну залежність щільності від температури. Тому не промерзають до дна великі водойми, що робить можливим існування в них життя.
Табл. 1 - властивості ВОДИ І ВОДЯНОГО ПАРА, що знаходиться в рівновазі
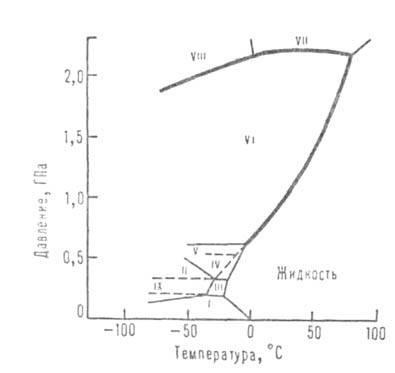
Мал. 1. Фазова діаграма води.
Взаємодія між молекулами води. Структура конденсованих фаз. Молекули води, володіючи значною ді-польним моментом, сильно взаємодія один з одним і полярними молекулами ін. Речовин. При цьому атоми водню можуть утворювати водневі зв'язки з атомами О, N, F, Cl, S і ін. В водяній парі при невисоких температурах і помірних тисках присутня невелика кількість (ок. 1% при температурі кипіння і атм. Тиску) димарів води ( для них
15 кДж / моль), відстань між атомами кисню
0,3 нм. У конденсованих фазах кожна молекула води утворює чотири водневі зв'язки: дві - як донор протонів і дві - як акцептор протонів. Середня довжина цих зв'язків в кристалічних. модифікаціях льоду і кристалогідратів ок. 0,28 нм. Кут О-Н. Про прагне до 180 °. Чотири водневі зв'язку молекули води спрямовані приблизно до вершин правильного тетраедра (рис. 2).
Структура модифікацій льоду є тривимірною сітку. У щільних модифікаціях VI-VIII, стійких при високому тиску, можна навіть виділити дві такі сітки, "вставлені" одна в іншу. У модифікаціях, що існують при низькому тиску (льоди Ih і Iс), зв'язку Н-О-Н майже прямолінійні і спрямовані до вершин практично правильного тетраедра. У модифікаціях II-VI зв'язку викривлені і кути між ними відрізняються від тетраедричного, що обумовлює збільшення щільності в порівнянні з щільністю звичайного льоду.
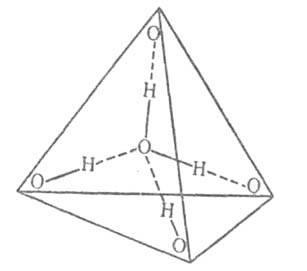
Мал. 2. Схема тетраедріч. координації молекули води; суцільні лінії - ковалентні зв'язку; пунктирні лінії - водневі зв'язку.
Але щільність модифікацій II-VI значно нижча за ту, якої міг би володіти лід при щільній упаковці молекул. Тільки в модифікаціях VII і VIII досягається досить висока щільність упаковки: в їх структурі дві правильні сітки, побудовані з тетраедрів (аналогічні існуючим в кубич. Низькотемпературному льоді Iс, ізоструктурні алмазу), вставлені одна в іншу; при цьому зберігається система прямолінійних водневих зв'язків, а координац. число по кисню подвоюється і досягає 8. Розташування атомів кисню в льодах VII і VIII подібно розташуванню атомів вжелезе і багатьох ін. металах. У звичайному (Ih) і кубічному (Іс) льодах, а також в льодах HI, V-VII орієнтація молекул не визначена: обидва найближчих до атому Про протона утворюють з ним ковалентні зв'язки, які може бути направлено до будь-яких двох з чотирьох сусідніх атомів кисню в вершинах тетраедра. Діелектричної. проникність цих модифікацій висока (вище, ніж у рідкої води). Модифікації II, VIII і IX ориентационно впорядковані; їх діелектрична проникність низька (бл. 3). Лід VIII є упорядкований за розміщення протонів варіант льоду VII, а лід IX - льоду III. Щільності ориентационно упорядкованих модифікацій (VIII, IX) близькі до плотностям відповідних невпорядкованих (VII, III).
Тривимірна сітка водневих зв'язків, побудована з тетраедрів, існує і в рідкій воді в усьому інтервалі від температури плавлення до критичної. Збільшення щільності при плавленні, як і в випадку щільних модифікацій льоду, пояснюється викривленням водневих зв'язків і відхиленням кутів між ними від тетраедричних. Викривлення зв'язків збільшується зі зростанням температури і тиску, що призводить до зростання щільності. З ін. Боку, при нагріванні середня довжина водневих зв'язків стає більше, в результаті чого щільність зменшується. Спільна дія двох факторів пояснює наявність максимуму щільності води при 3,98 ° С.
Хімічні властивості. Лише незначною частка молекул (при 25 ° С - приблизно 1 на 5 * 10 9) піддається електролітич. дисоціації за схемою: Н2 ОН + + ОН -. Протон Н + у водному середовищі, взаємодіючи з молекулами води, утворює Н3 Про +. об'єднується з 1 молекулою Н2 О в H5 O2 +. Відстань О. О в таких комплексах помітно коротше довжини нормальної водневого зв'язку між нейтральними молекулами. Але оскільки протон, мабуть, знаходиться не точно посередині цієї укороченою зв'язку, а ближче до одного з атомів О, можна вважати, що в воді існує гідратований іон оксония Н3 Про +. Це явище відіграє велику роль в хімічний процесах, що відбуваються в різні системах, в тому числі біологічних. Зокрема, дисоціація води - причина гідролізу солей слабких кислот і (або) підстав. Концентрація іонів Н + і пов'язана з нею концентрація іонів ОН --важливі характеристики водних розчинів (див. Водневий показник). Ступінь електролітич. дисоціації води помітно зростає при підвищенні температури.
Освіта води з елементів по реакції Н2 + 1/2 O2 Н2 O (H o обр -242 кДж / моль для пара і -286 кДж / моль для рідкої воді) при низьких температурах під час відсутності каталізаторів відбувається вкрай повільно, але швидкість реакції різко зростає при підвищенні температури, і при 550 ° С вона відбувається з вибухом. При зниженні тиску і зростанні температури рівновага зсувається вліво. Ступінь термодинамічно дисоціації води (%) при 100 кПа: 0,034 (1015 ° С), 0,74 (1711 ° С), 8,6 (2215 ° С) і 11,1 (2483 ° С). Під дією УФ-випромінювання відбувається фотодисоціація води на іони Н + і ОН -. Іонізуюче випромінювання викликає радіоліз води з утворенням Н2. Н2 О2 і вільний радикалів; радиац. вихід - приблизно 4 розпалися молекули на кожні 1,6 * 10 -17 Дж поглиненої енергії випромінювання.
Вода - реакційно з'єднання. Вона окислюється атомарним киснем: Н2 О + О -> Н2 О2. При взаємодія води з F2 утворюються HF, а також О, О2. О3. Н2 О2. F2 O і ін. З'єднання. З іншими галогенами при низьких температурах вода реагує з утворенням суміші кислот HHal і ННаlO. При звичайних умовах з водою взаємодія до половини розчиненого в ній Cl2 і значно менші кількості Вr2 і 12. При покращення. температурах хлор і бром розкладають воду з утворенням HHal і О2. При пропущенні парів води через розпечене вугілля вона розкладається і утворюється так званої водяний газ: Н2 О + С СО + Н2. При покращення. температурі в присутності каталізатора вода реагує з СО, СН4 та ін. вуглеводнями, наприклад: Н2 О + СО СО2 + Н2 (каталізатор Fe); Н2 О + СН4 СО + ЗН2 (каталізатор Ni або З). Ці реакції використовують для пром. отримання Н2. Перспективні для його виробництва також термохимический способи розкладання води (див. Водень, Воднева енергетика). Фосфор при нагріванні з водою під тиском у присутності каталізатора окислюється в метафосфорную кислоту: 6Н2 О + ЗР -> 2НРО3 + 5Н2. Вода взаємодія зі багато металами з утворенням Н2 і відповідного гідроксиду. З лужними і щел.-зем. металами (крім Mg) ця реакція протікає вже при кімнатній температурі. Менш активні метали розкладають воду при підвищ. температурі, наприклад Mg і Zn-вище 100 ° С, Fe - вище 600 ° С (2Fe + ЗН2 Про -> Fe2 O3 + 3H2). При взаємодія з води багатьох оксидів утворюються кислоти або підстави. Вода може служити каталізатором, наприклад лужні метали і водень реагують з хлором тільки в присутності слідів води Іноді вода - каталітичних отрута, наприклад для залізного каталізатора при синтезі NH3.
Здатність молекул води утворювати тривимірні сітки водневих зв'язків дозволяє їй давати з інертними газами, вуглеводнями, СО2. Cl2. (СН2) 2 О, СНCl3 і багатьма ін. Речовинами так званої газові гідрати.
Вода як розчинник. Вода добре розчиняє багато полярні і диссоциирующие на іони речовини. Зазвичай розчинність зростає зі збільшенням температури, але іноді температурна залежність має більш складний характер. Так, розчинність багато сульфатів, карбонатів і фосфатів при підвищенні температури зменшується або спочатку підвищується, а потім проходить через максимум. Розчинність малополярних в-в (в тому числі газів, що входять до складу атмосфери) в воді низька і при підвищенні температури зазвичай спочатку знижується, а потім проходить через мінімум. З ростом тиску розчинність газів зростає, проходячи при високому тиску через максимум. Багато речовин, розчиняючись у воді, реагують з нею. Наприклад, в розчинах NH3 можуть бути присутніми іони NH4 (див. Також Гідроліз). Між розчиненими у воді іонами, атомами, молекулами, які не вступають з нею в хімічний реакції, і молекулами води існують не руйнують їх іон-дипольні і межмол. взаємодії (див. Гідратація).
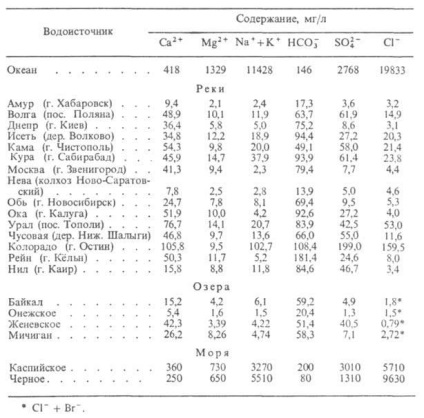
Природна вода. Являє собою складну багатокомпонентну систему, до складу якої входять мінеральних речовини, гази, а також колоїдні і крупнодисперсні частки, в тому числі мікроорганізми. За величиною мінералізації (г / л) розрізняють наступної природні води: ультрапрісні - до 0,2, прісні - 0,2-0,5, слабо - 0,5-1,0, солонуваті - 1-3, солоні - 3 10, з підвищ. солоністю - 10-35, перехідні до розсолу - 35-50, розсоли - більше 50. макрокомпонентами природної води зазвичай є Са, Mg, Na, К, Fe (катіоногенние води), Si, С, S, Cl (аніоногенних води). До мікрокомпонента природної води відносяться рідкісні і рудні елементи, наприклад В, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I і ін.
Осн. гази, що містяться в природні воді, - СО2. N2 (характерні як для поверхневих, так і для глибинних умов), СН4. СО, Н2 (більш типові для підземних водах і для води вулканічних. Активних областей). Розчинені у воді компоненти знаходяться в рівновазі, утворюючи комплекси різні складу. Дані про склад деяких природної води наведені в табл. 2.
Табл. 2-СКЛАД ПРИРОДНИХ ВОД
Питна вода. Загальна кількість мікроорганізмів в 1 мл питної води має бути не вище 100, число бактерій групи кишкових паличок (колі-індекс) - не більше 3. Концентрація хімічний речовин, які зустрічаються в природній воді або додаються до води при її обробці (див. Водопідготовка) , не повинна перевищувати (мг / л):

Технічна вода. Воду, що витрачається пром. підприємствами, прийнято називають технічної. Її застосовують головним чином в якості охолоджуючого агента, транспортує середовища для сипучих матеріалів (наприклад, гідротранспорт золи на теплових електростанціях), розчинника та ін. В цілому по всіх галузях промисловості 70-75% від загальної витрати води застосовують як холодоагент по циркуляції. схемою. В цьому випадку вода лише нагрівається і практично не забруднюється. Головні джерела забруднення охолоджуючої води систем циркуляції. водопостачання - вода, що додається в системи для поповнення неминучих втрат, і атм. повітря, з до-poro вимиваються в охолоджувачах води зважені речовини і гази, розчинні у воді.
Лікувальні води. В якості лікувальних застосовують природній воді, що містять значну кількість мінер, солей, гази, деякі елементи і ін. (Докладніше див. Мінеральні води).
В останні роки значно погіршилась якість питної води. Причиною тому послужило значне збільшення забруднюючих викидів як побутових, так і вироблених промисловими підприємствами. Зараз в воді знаходять хімічні, біологічні та навіть радіоактивні забруднення, які вкрай негативно впливають на здоров'я людини. Саме цим можна пояснити різко збільшений інтерес до систем очищення води. як у покупців, так і у виробників. Замислюючись про своє здоров'я, все більше людей встановлюють системи очищення води в квартирах, дачах, котеджах.