Рівняння Ван-дер-Ваальса пов'язує між собою основні термодинамічні параметри для реального газу.
При низькому тиску і високих температурах закон Менделєєва-Клапейрона також досить точно описує поведінку реальних газів, проте в інших умовах реальні гази значно відхиляються від ідеальності. Рівняння Ван-дер-Ваальса враховує ці відхилення.
Формула рівняння Ван-дер-Ваальса
Рівняння Ван-дер-Ваальса має вигляд:
У цьому рівнянні n - кількість молей газу, р - його тиск. V - займаний газом обсяг, Т - абсолютна температура газу. Універсальна газова стала має значення 8,31441 Дж / (моль • К), однакове для всіх газів.
Мінлива а - це поправка на силу тяжіння між молекулами газу. Під дією цієї сили молекули притягуються один до одного, всередину газу, зменшуючи тиск на стінку. Мінлива b - поправка, що враховує власний обсяг, яку він обіймав молекулами газу. Ці поправки залежать від виду газу, і можуть бути знайдені з таблиць або розраховані за наступними формулами:
Тут і - це тиск і абсолютна температура газу в критичній точці, тобто в точці переходу газоподібної фази в рідку.
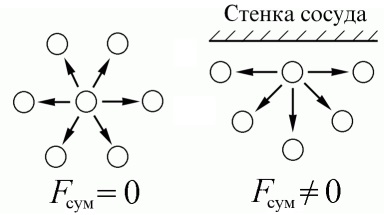
У реальному газі відстані між молекулами менше, ніж в ідеальному, і можна порівняти з розмірами самих молекул. Тому сили взаємодії між молекулами стають досить великими. В обсязі газу молекула з усіх боків оточена іншими молекулами, і сили їх тяжіння врівноважуються. Однак коли молекула наближається до стінки, сили тяжіння більше не врівноважуються і «втягують» її всередину. Тому молекула рухається до стінки повільніше, через що тиск на стінку зменшується. Це і враховує поправка а.
Крім того, за рахунок сил міжмолекулярної взаємодії реальні гази здатні переходити в рідкий стан, і рівняння Ван-дер-Ваальса досить точно описує поведінку газів поблизу цього переходу.
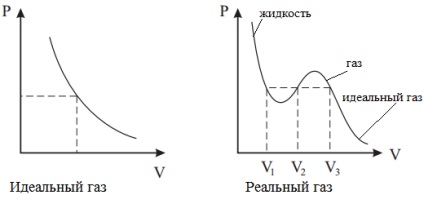
Так як в реальному газі відстань між молекулами порівняно невелика, молекула повинна пролетіти меншу відстань, щоб вдаритися об стінку. Тому при дуже високому тиску тиск на стінку зростає, і це враховує поправка b.
Рівняння Ван-дер-Ваальса застосовується, зокрема, при визначенні параметрів пара в теплотехніці і теплотехніки, при дослідженні скраплення газів.
Приклади розв'язання задач
Яку температуру має азот масою 2 грами, що займає обсяг 800 см при тиску 0,2 МПа, якщо його розглядати як реальний газ?
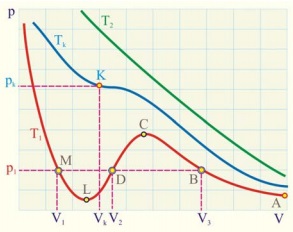
Помноживши рівняння Ван-дер-Ваальса на і розділивши на p, отримаємо кубічне рівняння щодо обсягу:
Це рівняння має три корені. У точці перегину, показаної на малюнку, всі ці коріння дійсні і рівні один одному. Точка перегину і є критичною точкою, в якій газоподібна фаза переходить в рідку.
Щоб знайти критичні параметри, скористаємося властивостями точки перегину: перша і друга похідна рівняння звертаються в нуль.
Вирішимо ці рівняння щодо обсягу і температури, отримаємо критичні параметри:
Висловивши тиск з рівняння Ван-дер-Ваальса і записавши це рівняння для критичних параметрів, отримаємо:
Підставами в це рівняння, і після рішення отримаємо:
Запишемо систему рівнянь:
Знайдемо з неї b:
Підставивши b в друге рівняння системи, отримаємо: