одне з перших рівнянь стану реального газу. Запропоновано в 1873 голл. фізиком Я. Д. Ван-дер-Ваальса (J. D. van der Waals). Для благаючи газу, що має об'єм V при темп-ре Т і тиску р, має вигляд:
де R - універсальна газова стала. а a і b - т фіз. константи, що враховують відхилення св-в реального газу від св-в ідеального. Так, член a / V2 має розмірність тиску і враховує тяжіння молекул в результаті міжмолекулярної взаємодії, а константа b - поправка на собств. обсяг молекул, що враховує відштовхування молекул на близьких відстанях. При великих V (а також для розріджена. Газів) константами а й можна знехтувати і В. у. переходить в ур-ня стану ідеального газу (див. Клапейрона Рівняння).
В. у. явл. наближеним і кількісно визначає св-ва реальних газів лише в області високих Т і низьких р. Однак якісно воно дозволяє описувати поведінку газу при високих р, конденсацію газу і критич. стан.
На малюнку наведені ізотерми, розраховані по В. у. При низьких Т все три кореня В. У.- дійсні, а вище критичного. темп-ри (Тк) залишається лише один действит. корінь. Це означає, що при Т> ТК в-во може перебувати тільки в одному (газоподібному) стані, а при Т
- рівняння стану реального газу. Запропоновано І. Д. Ван-дер-Ваальса (J. D. van der Waals) в 1873. Для газу, що містить N молекул, В. у. має вигляд:
де V - об'єм, р - тиск, T - абс. темп-pa газу, а й b - постійні, що враховують тяжіння і відштовхування молекул. Член зв. внутр. тиском, постійна b дорівнює учетверённому обсягом молекули газу, якщо в якості моделі молекули прийняти слабо притягуються пружні сфери.
В. у. кількісно визначає властивості реальних газів лише в невеликому інтервалі Т і р - в області відносно високих Т і низьких р, т. к. а і b є ф-ціями темп-ри. Однак В. у. якісно правильно описує поведінку газу і рідини і при високих р, а також особливості фазового переходу між ними. При низькому тиску і відносно високих темп-pax воно переходить в ур-ня стану ідеального газу (Клапейрона рівняння), а при високому тиску і низьких темп-pax враховує малу стисливість рідин. В. у. описує, крім того, критичне і ме-тастабільное стану системи рідина - пар.
На рис. наведені в координатах р - V ізотерми, розраховані по В. у. що є кубічним щодо V. Можливі 3 випадки рішення В. у. 1) всі три кореня дійсні і рівні між собою; цей випадок відповідає критич. станом (ізотерма Ткр; 2) всі три корені дійсні і різні - т. зв. докрітіч. стан (ізотерми при T
Геом. місце початкових і кінцевих точок "рівноваги" а і з стабільної і метастабільною фаз (визначається з умови рівності заштрихованих площ) наз. бінодалью (крива АКС). Крива, що з'єднує екстремальні точки типу d і е, наз. спінодаль (крива dKe). Область, укладена між бінодалью і спінодаль, - область нестійкого, метастабілен-ного стану системи. T. о. ділянки ізотерм типу ad і ес відносяться до метастабильному рівноваги відповідно перегрітої рідини і системи рідина + газ. а також системи рідина + газ і переохолодженого газу. Ділянка dbe не має фіз. сенсу, т. к. на цій ділянці при зростанні р збільшується і V, що неможливо.
При досить низьких темп-pax ділянку adb опускається нижче ізобари р = 0. В цьому випадку має фіз. сенс ділянку ad потрапить в область отрицат. тисків, що відповідає нестійкого стану розтягнутої рідини.
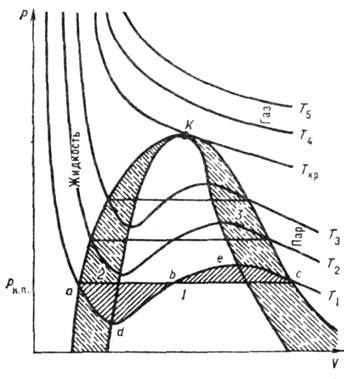
Діаграма стану речовини в координатах p-V: T1 За допомогою В. у. можна отримати критич. параметри ркр. V Кp і Tкp. У точці К ізотерми Ван-дер-Ваальса мають як максимум, так і точку перегину, т. Е.. Рішення системи ур-ний Ван-дер-Ваальса і двох наведених вище має вигляд: Незважаючи на те, що постійна b має підгінним характер, розміри молекул, отримані за допомогою виразу. добре узгоджуються з отриманими ін. методами. В. у. в к-рої введені відносить. величини T / Ткр. р / ркр. T / T кр, наз. наведеними рівнянням стану; воно має більш широке застосування, ніж В. у. Якщо в Ст в. тиск розкласти по ступенях щільності і порівняти з віриалів розкладанням, то постійні а й b можна виразити через коефіцієнти віриалів. Літ. см. при ст. Газ. Ю. H. ЛюбитівСхожі статті